O entendimento das pessoas evolui à medida que a ciência avança, e novas descobertas são feitas. Nesta dinâmica, o avanço médico e científico ao longo dos últimos anos teve um impacto significativo no diagnóstico e na percepção médica sobre as doenças.
Com o desenvolvimento de novas tecnologias, métodos de pesquisa e compreensão biológica, o conhecimento genético avançou de maneira notável, especialmente após se ter conseguido fazer o o mapeamento do genoma humano. Agora, através do resultado genético é possível não só diagnosticar uma doença, mas entender seu impacto no indivíduo, e adaptar as abordagens com base no perfil genético de cada paciente.
Nestes meus mais de 60 anos, senti na pele essa grande reviravolta na ciência, no que diz respeito ao conhecimento médico e diagnóstico da minha doença. Vivi até meus 44 anos, com vários diagnósticos errados, abordagens diferentes, até que tive finalmente o diagnóstico sobre a doença que me afeta, a Miopatia Congênita Centronuclear (MCC). Essa doença é causada pela mutação no gene RYR1, não tem cura, nem tratamento. Apesar da dureza sobre as informações sobre a doença, ter o diagnóstico de certa forma me trouxe uma “espécie de alívio“. O RYR1 é responsável pelo controle do fluxo de íons de cálcio para dentro da célula muscular, que faz o músculo contrair e relaxar.
Naquela época, o resultado histológico, feito por uma biópsia muscular, era tido como sendo uma informação importante no diagnóstico, e acompanhamento clínico, porque através dele podia-se saber e diferenciar se o indivíduo era afetado por exemplo, por Miopatia Congênita Centronuclear (MCN), Miopatia Central Core (MCC), Doença Multi-Minicore (DMm), ou Desproporção Congênita do Tipo de Fibra (DCTF). Aconteceu que através de minha vivencia em meio ao pequeno mundo dos afetados por essa doença, pude ver diferentes pessoas afetadas por MCN com a evolução diferente, assim como comparados com indivíduos em pior condições físicas em relação a um outro com MCC, ou DCTF, da mesma verificando também no inverso.
O avanço das técnicas de diagnóstico genético, nos trouxe uma mudança significativa, permitindo identificar diretamente variantes no gene RYR1, possibilitando uma visão mais precisa e específica da doença. Essa abordagem é preferível porque pode confirmar a presença de alterações no gene, mesmo na ausência de características histopatológicas distintivas, permitindo uma melhor orientação do prognóstico e o acompanhamento clínico do paciente.
Passado um tempo, descobri que no diagnóstico da doença, a histologia não tem um papel tão relevante quanto anteriormente, mas sim a herança e variação genética, em que é separado as formas recessivas e dominantes. Clinicamente observa-se evolução clínica com quadros mais graves em indivíduos com herança recessiva.
Em recente conversa com Michael F. Goldberg, MD, MPH, Presidente do Conselho, Co-Presidente de Pesquisa e Co-Fundador da @theryr1foundation, ele me disse: “Casos recessivos de RYR-1 tendem a ser mais graves quando associados a variantes do gene RYR1 resultando em expressão reduzida da proteína receptora RYR-1. As formas dominantes tendem a ser menos graves porque essas variantes geralmente não resultam em quantidades reduzidas da proteína receptora RYR-1. Os diagnósticos histopatológicos derivados da biópsia muscular (por exemplo, Centronuclear, Central Core, ou DCTF, etc.) não parecem ser muito informativos e não são específicos para fenótipos específicos mesmo para RYR1. Portanto, houve um afastamento do diagnóstico histopatológico e uma ênfase maior no diagnóstico genético .”
Em resumo, os diagnósticos histopatológicos obtidos a partir de biópsias musculares, como Centronuclear, Central Core, Desproporção Congênita do Tipo de Fibra, ou Multi Mini Core, não são muito informativos, e não são específicos para certos fenótipos. Isso levou a uma mudança para um maior enfoque no diagnóstico genético, que é mais preciso e informativo. Esse avanço no entendimento científico, permitiu a identificação e conhecimento das variantes genéticas, e sua relação com a gravidade das doenças associadas ao gene RYR1, crucial para um diagnóstico eficaz, e para o desenvolvimento de abordagens adequadas ao paciente.
A Miopatia Congênita Centronuclear é uma condição neuromuscular rara, com características de progressividade, e que pode levar a diversas complicações, incluindo problemas ortopédicos, como já relatado em postagem anterior (clique aqui), mas também podem ocorrer complicações respiratórios. As questões respiratórias podem surgir devido à fraqueza muscular que afeta os músculos respiratórios, resultando em dificuldades na ventilação e na troca gasosa. Para melhor entender o contexto desta questão das complicações respiratórias em indivíduos com miopatia relacionada ao RYR-1, o texto a seguir será dividido em tópicos conceituais e explanatórios.
OXIGÊNIO E O SISTEMA RESPIRATÓRIO
O oxigênio é de vital importância para o corpo humano, especificamente a cada célula, órgão e sistema do organismo. No caso dos músculos, o oxigênio desempenha um papel fundamental, como segue:
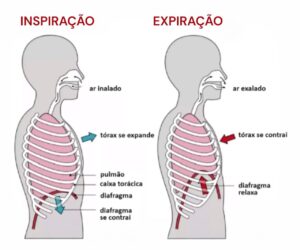 O sistema respiratório, através do processo de respiração, é o responsável por alimentar todo nosso oragnismo de oxigênio, elemento tão precioso e responsável por nos manter vivos. A respiração é um processo involuntário e automático que ocorre em duas etapas: Inspiração e Expiração.
O sistema respiratório, através do processo de respiração, é o responsável por alimentar todo nosso oragnismo de oxigênio, elemento tão precioso e responsável por nos manter vivos. A respiração é um processo involuntário e automático que ocorre em duas etapas: Inspiração e Expiração.
Trazendo toda essa questão da respiração para o contexto de um portador de uma miopatia, deve-se destacar que o diafragma é o principal músculo respiratório. O processo respiratório funciona assim:
RESPIRAÇÃO EM UM INDIVÍDUO COM MIOPATIA
Um indivíduo com miopatia tende ter fraqueza no diafragma e nos músculos abdominais, e essa situação pode dificultar a desobstrução das vias aéreas, pois se torna difícil inspirar profundamente e expirar de forma forte e completa. Se por exemplo um indivíduo com miopatia pega um resfriado, com seus músculos respiratórios enfraquecidos, ele pode desenvolver uma pneumonia. Esse processo inflamatório nos pulmões pode enfraquecer ainda mais os músculos e causar mais problemas na desobstrução das vias aéreas. A parede torácica e o abdômen formam a caixa torácica. Se a parede torácica estiver fraca, durante a inspiração, o tórax pode se movimentar para dentro em vez de se mover para fora. Isso dificulta ainda mais a respiração profunda. À medida que a parede torácica se enfraquece e se movimenta menos, ela também fica rígida. A rigidez da parede torácica torna ainda mais difícil a respiração profunda.
A fraqueza da caixa torácica também pode causar instabilidade da coluna. Isso pode causar uma curvatura na coluna, o que resulta em cifose ou "corcunda" nas costas. Essa instabilidade também pode causar a curvatura lateral da coluna, o que resulta em escoliose. Essas curvaturas podem limitar o movimento da parede torácica durante a respiração, o que dificulta a respiração profunda e resulta em menor volume dos pulmões. Juntos, esses problemas podem levar a uma situação em que os músculos respiratórios não funcionam bem o suficiente para trazer oxigênio para dentro do corpo e eliminar o dióxido de carbono. Isso se chama insuficiência respiratória.
COMPLICAÇÕES RESPIRATÓRIAS EM UM INDIVÍDUO COM MIOPATIA
Assim como ocorre com outros sintomas nos indivíduos afetados por uma das doenças relacionadas ao RYR-1, a gravidade das complicações respiratórias também varia de indivíduo para indivíduo. Assim, algumas pessoas com doenças relacionadas ao RYR-1 podem não ter problemas. Alguns podem ter problemas leves, mas precisam de auxílio para respirar durante o sono ou quando estão doentes. Em casos graves, alguém com doença relacionada ao RYR-1 pode precisar de ventilação mecânica para respirar. Segue algumas das complicações respiratórias que podem ocorrer incluem:
É importante que os indivíduos com Miopatia Congênita Centronuclear sejam monitorados de perto quanto à função respiratória e recebam cuidados multidisciplinares para gerenciar eventuais complicações. O diagnóstico preciso de complicações respiratórias envolve uma variedade de exames que permitem aos médicos avaliar a função pulmonar, iniciando por um exame clínico, raio-x, tomografia computadorizada, teste de função pulmonar (TFP), polissonografia, exames laboratoriais, dentre outros. Uma vez identificado uma complicação respiratória, o tratamento pode incluir fisioterapia respiratória, suporte ventilatório e acompanhamento regular com especialistas em pulmão. E caso o indivíduo, afetado por Miopatia Centronuclear pela mutação no RYR-1, necessite de hospitalização, é importante se ter preventivamente um plano de suporte respiratório e orientação clínica. Na necessidade de uma cirurgia, os médicos deverão adotar precauções para suporte respiratório antes e depois da cirurgia, além de serem alertados sobre a sussetibilidade à Hpertermia Maligna.
ABORDAGENS RESPIRATÓRIAS PREVENTIVA E TERAPEUTICA EM UM INDIVÍDUO COM MIOPATIA¹
Assim como relatado em postagem anterior Abordagem Respiratória na Miopatia Centronuclear (clique aqui) a fisioterapia respiratória é responsável pela minimização dos comprometimentos respiratórios nas miopatias centronucleares, pois interfere na progressão da perda muscular, minimiza as complicações da perda de capacidade pulmonar, mantem a funcionalidade respiratória como fala, deglutição e tosse. Fazem parte das estratégias utilizadas no tratamento:
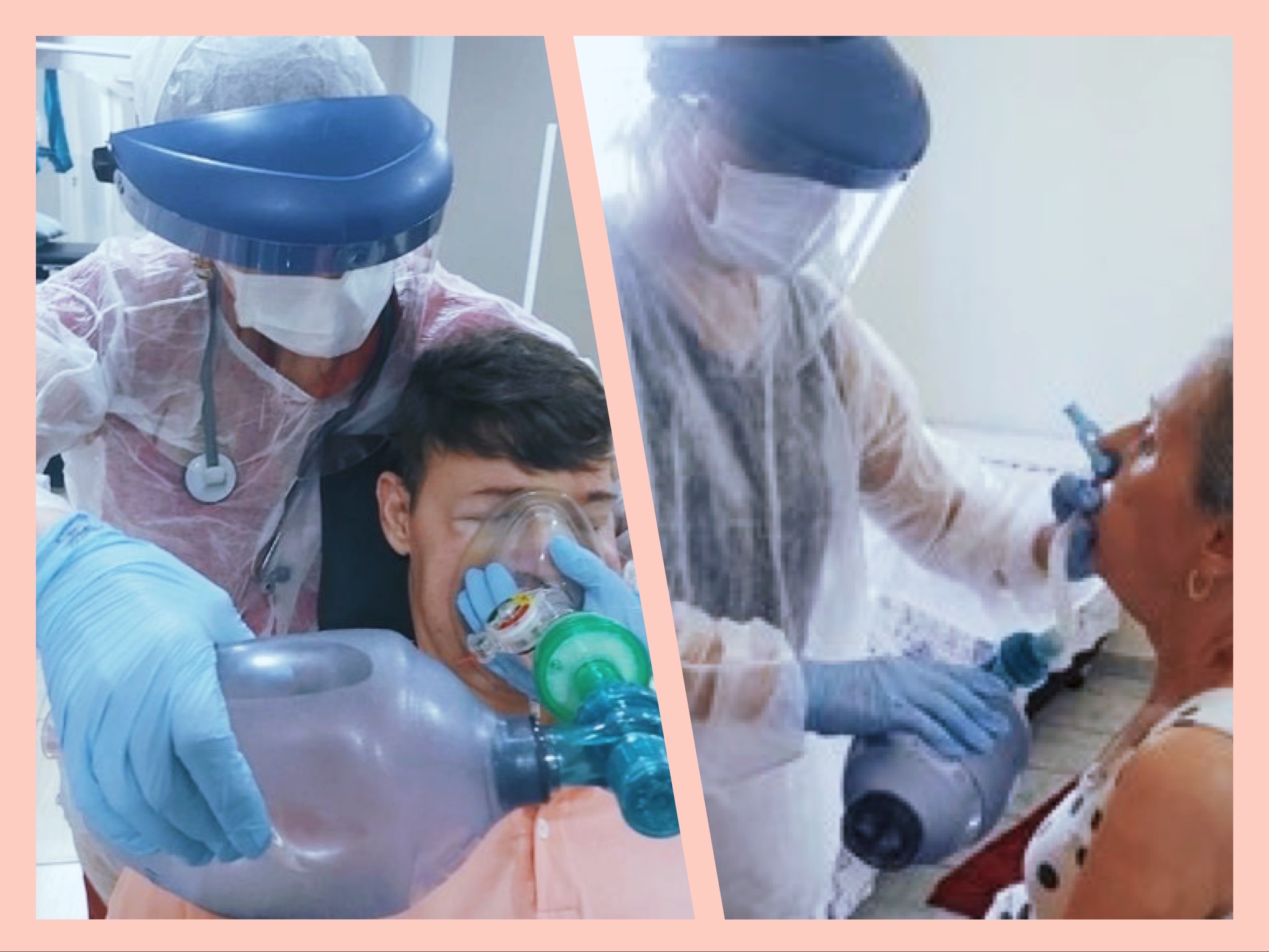
Fig 1 -Exercício de empilhamento de ar \ Fig 2 - Exercícios respiratórios para manutenção da capacidade pulmonar e treinamento da musculatura bulbar (ambos utilizando a bolsa de insuflação (ambu)
O cuidado respiratório deve ser uma prioridade nos portadores de Miopatia Centronucelar, e o profissional deve ser capaz de identificar a alteração funcional e correlacionar com a melhor terapia a ser aplicada, sendo esta a melhor estratégia para evitar maiores complicações para o paciente.
¹ texto cedido por colaboração da fisioterapeuta Alessandra Dorça do Instituto Alessandra Dorça @institutoaledorca
Hans Christian, um escritor dinamarquês conhecido mundialmente por suas histórias infantis, certa vez disse, "Onde as palavras falham, a música fala", e eu completo dizendo que a música é um meio de transporte capaz de dirigir nossas emoções e sensações a todos os sentimentos. Contudo, através da música pude também experimentar outros benefícios além do que normalmente esperado, e que vou contar a seguir qual foi…
Quando Luciano (meu filho) se foi aos 23 anos de idade, eu busquei de alguma forma me manter próximo dele alimentando as lembranças sobre ele. Luciano, parece ter vivido pouco tempo de vida, sim, mas ele fez muito… ele foi triatleta, músico multi-instrumentista, dentre outros feitos. Com esta vontade que tive de buscar estar perto dele, pensei, no esporte não vou conseguir viver o que ele viveu, daí decidi ir de encontro com ele pelo caminho da música e então tocar violino, seu principal instrumento musical desde os 6 anos de idade. Música sempre foi algo que fez parte do dia a dia de nossa família, e cremos que Deus além de usar a música para falar conosco, ele nos concedeu o dom da musicalidade, daí não vi maiores dificuldades e resolvi embarcar nessa jornada. O Professor Ricardo Seoud embarcou comigo nesta grande empreitada para me ajudar a conquistar o objetivo de aprender a tocar violino, contudo eu sabia que antes iria precisar romper com minhas barreiras de dificuldade física para conseguir segurar o instrumento. Sendo assim, além do meu professor Seoud, contei com o trabalho conjunto de Lorena, minha fisioterapeuta, a qual me acompanhou fazendo as devidas orientações de técnicas de exercícios de consciência corporal, educação postural, alongamentos, e respiração.
Existe um fato interessante que liga minha relação como portador de deficiência física ao de tocar um instrumento musical. Quando era criança minha mãe me colocou na aula de violão, e mais tarde me deu uma flauta, não entendia o porque, mas e hoje pude concluir que mesmo com sua simplicidade sobre o entendimento da doença que me acometia, o que ela realmente buscava era promover a minha educação física, e com a flauta o meu condicionamento respiratório. Não existia conhecimento técnico que tocar um instrumento musical poderia funcionar como uma forma de fisioterapia. Naquela época, as minhas limitações físicas ainda não estavam tão severas como atualmente, hoje o simples fato de conseguir segurar o violino é o meu grande desafio. Lembro que nas primeiras aulas, Sissi, minha esposa, precisava colocar duas a três almofadas sob meu braço para servir de apoio de sustentação para conseguir segurar o instrumento, mas que no decorrer dos treinamentos eu superei e consegui manter o instrumento na posição correta, ou melhor, meio correta, e penso que foi Luciano quem estaria me ajudando fisicamente, não com o triathlon, mas com o simples ato de conseguir fisicamente segurar o violino.
Sabe-se através do conhecimento fisiológico, que o ato de tocar um instrumento musical envolve uma série de movimentos físicos que podem ajudar a melhorar a coordenação motora, a força muscular e a flexibilidade, além de estimular áreas do cérebro relacionadas à motricidade e à cognição. No mais, a música pode ter um efeito terapêutico, promovendo relaxamento, reduzindo o estresse e melhorando o bem-estar emocional.
É um entendimento, que toda forma de atividade física é crucial e benéfica para o condicionamento físico dos portadores de miopatia, inclusive como sendo a única e comprovada forma de tratamento. E no caso, pela minha experiência pessoal pude concluir que o ato de tocar um instrumento musical, é um exercício físico que atuou verdadeiramente como um complemento à minha rotina diária de fisioterapia proporcionando os seguintes benefícios:
Por fim, gostaria de ilustrar e celebrar esta postagem com uma música muito significativa para mim (senti A música escolhida, Londonderry Air, é uma ária publicada em 1855, e que se tornou como um hino irlandes, sendo considerada uma das canções mais tocadas no mundo, e que teve muitas versões de letras, mas a mais conhecida e autêntica foi Danny Boy, composta por um inglês em 1910. Sua melodia emotiva e letra tocante, fala sobre a despedida, e espera de um amor eterno, com uma mensagem de esperança e a promessa de que o amor por alguém persistirá além da vida.
...ao abrir o video no yoytube, click no canto direito inferior no icone ⌈ ⌉ para abrir a imagem em toda a tela
A grande maioria das pessoas a partir dos 50 anos se deparam com complicações ortopédicas, seja nas articulações, coluna, quadril, dentre outros, e isso geralmente se deve pelo uso inadequado do corpo gerando os desgastes naturais que acontecem no decorrer da vida, ou acontece também pela falta de exercícios físicos.
No caso do indivíduo portador de miopatia centronuclear, doença essa causada pela mutação no gene RYR-1, responsável pelo funcionamento dos músculos, as implicações ortopédicas em relação a uma pessoa sem a doença, é potencializada, e pode levar a uma série de complicações já desde o nascimento. Como já explicado em postagens anteriores, cada pessoa com doença relacionada ao RYR-1 é única, assim como a evolução da doença, as complicações também podem afetar diferentemente cada indivíduo.
Nesta postagem, vou discorrer sobre alguns dos principais problemas ortopédicos com os quais pessoalmente convivo, e que podem ocorrer com os indivíduos afetados por uma doença relacionada ao RYR-1, que são:
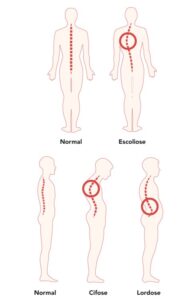
 nas articulações e tendões. No nosso caso, portadores de miopatia, a situação é logicamente agravada, porque como nossos músculos não são utilizados adequadamente, o enfraquecimento muscular é aumentado, resultando em instabilidade nas articulações, e isso pode aumentar o risco de lesões, como distensões ou rupturas de tendões. Além disso, a imobilidade por fraqueza muscular pode levar à rigidez articular e à perda de amplitude de movimento, o que pode causar dor e desconforto. Essa falta de mobilidade muscular também pode contribuir para o desenvolvimento de condições como a artrite, pois as articulações não recebem o movimento necessário para manter a saúde e a lubrificação adequada.
nas articulações e tendões. No nosso caso, portadores de miopatia, a situação é logicamente agravada, porque como nossos músculos não são utilizados adequadamente, o enfraquecimento muscular é aumentado, resultando em instabilidade nas articulações, e isso pode aumentar o risco de lesões, como distensões ou rupturas de tendões. Além disso, a imobilidade por fraqueza muscular pode levar à rigidez articular e à perda de amplitude de movimento, o que pode causar dor e desconforto. Essa falta de mobilidade muscular também pode contribuir para o desenvolvimento de condições como a artrite, pois as articulações não recebem o movimento necessário para manter a saúde e a lubrificação adequada.
Para concluir, eu diria que as complicações ortopédicas acima descritas podem ser inevitáveis aos portadores de miopatias relacionadas ao RYR1, sejam elas por origem congênita, ou em decorrência das adaptações que o indivíduo precisa fazer para conseguir movimentar durante a vida, ou pelas que acontecem com o desgaste natural do envelhecimento. Como portador de Miopatia Congênita Centronuclear, eu convivo com todas as complicações descritas, e de todas as origens de causas. Contudo, vejo que existem formas de se prevenir, postergar o seu surgimento ou agravamento, e até de se mitigar os sintomas das complicações ortopédicas. A educação postural, e o desenvolvimento pessoal de consciência corporal, devem fazer parte do nosso dia a dia. No caso de as complicações já terem se instaladas, o manejo desses problemas geralmente envolve uma combinação de fisioterapia, alongamentos, terapia ocupacional e, em alguns casos as intervenções cirúrgicas para corrigir deformidades ou melhorar a função do corpo. Por fim, é fundamental que os portadores de miopatia centronuclear sejam acompanhados por uma equipe multidisciplinar para abordar essas questões de forma abrangente, preventiva e terapêutica.
Por 44 anos vivi sem diagnóstico, ou ainda pior, com diagnósticos errados, depois do diagnóstico vivi sem informações sobre a doença, e sem saber se a ciência se movimentando em favor da doença que me afetava. Daí a razão em ter lançado o SorRYR-1, com o propósito de transmitir minhas experiências de vida, sobre por exemplo como fiz para chegar até aqui, mas também de informar a sociedade sobre a doença, aconselhar indivíduos afetados e seus familiares, além de participar e suportar pesquisas que possam de alguma forma beneficiar os portadores de uma doença relacionada à mutação no gene RYR1.
Atualmente me considero realizado na medida em que vejo os obejtivos traçados originalmente com a concepção do SorRYR-1 se cumprir. E na esteira desta constante linha de trabalho, recentemente tive a oportunidade e honra de contribuir através da Fundação RYR-1 com o financiamento de um Estudo de Prevalência liderado por Heinz Jungbluth, MD, PhD, do King's College London, uma autoridade de renome em Doenças Relacionadas ao RYR-1 (RYR-1-RD). Este estudo ocorrerá com a multi colaboração de diversos centros de pesquisa na Europa.
A necessidade urgente de avanços na compreensão científica ressalta a urgência da pesquisa e desenvolvimento de tratamentos eficazes visando a cura e melhoria da qualidade de vida do indivíduo portador de uma doença relacionada ao RYR1, justificando assim o estudo em questão.
O Estudo de Prevalência é uma pesquisa que visa determinar a frequência com que uma determinada doença afeta uma população específica. No caso específico, o trabalho acontecerá com indivíduos portadores de doenças relacionadas à mutação do RYR1.
Entendo que o estudo deverá envolver a coleta de dados de indivíduos identificados com os tipos diagnosticados da doença, análise genética para identificar mutações no RYR-1, avaliação de fatores demográficos, e clínicos que possam influenciar a prevalência. Os resultados dessa pesquisa deverá ajudar a entender a magnitude do impacto dessas doenças, identificar o universo de indivíduos afetados, classificar grupos, e informar estratégias de saúde pública e intervenções médicas. Ao estabelecer a real prevalência das doenças relacionadas ao RYR-1, este estudo esperançosamente deverá propiciar a alavancagem de mais investimentos por empresas farmacêuticas, pesquisadores, empresas de biotecnologia e empresas de capital de risco. Em última análise, a esperança é que o resultado deste trabalho acelere ainda mais o desenvolvimento de terapias para doenças relacionadas ao RYR-1.
“Strength In Numbers” é o grande mote da Fundação RYR1, e que nos move enquanto comunidade de indivíduos portadores de doenças relacionadas ao RYR1 para chegarmos a uma solução como tratamento e cura.
Responder perguntas relacionadas à miopatia que me acomete é um dos meus propósitos com o SorRYR-1. Uma pergunta que sempre me fazem, e a resposta sempre causa uma certa confusão a quem respondo é o fato de meu CPK ser normal. Acredito que isso se dá pela desinformação de muitas pessoas entender que as miopatias estão diretamente ligadas a uma alteração dos níveis de CPK.
O CPK, também conhecido como creatinoquinase, é uma enzima encontrada no tecido muscular. Os níveis elevados de CPK podem indicar danos ou lesões nos músculos, coração ou cérebro. No entanto, é importante considerar que os níveis de CPK podem variar de pessoa para pessoa, e existem também várias condições de saúde e atividades físicas que podem levar a um aumento temporário nos níveis de CPK. Uma outra questão que os cientistas ainda pesquisam, e não tem uma resposta, é sobre porque os níveis de CPK se comportam de forma diferente nas miopatias, em alguns individuos em níveis alterado, em outros normal.
Os níveis elevados de CPK podem ser indicativos de várias condições de saúde, como exemplo:
Em uma miopatia, os níveis de creatinoquinase (CPK ou CK) podem variar, dependendo do tipo e da causa da miopatia. Em alguns casos, os níveis de CPK podem estar elevados, enquanto em outros casos podem ser normais ou até mesmo baixos. Portanto, não há uma resposta definitiva sobre o porquê dos níveis de CPK estarem altos ou baixos em uma miopatia, assim, é importante consultar um médico para obter um diagnóstico preciso e interpretar corretamente os resultados dos exames.
No meu caso com diagnóstico de Miopatia Congênita Centronuclear, sempre tive meus resultados de exames sempre com o CPK no nível da normalidade, portanto, é importante ressaltar que o diagnóstico da miopatia não é baseado exclusivamente nos níveis de CPK, mas sim por uma combinação de sintomas clínicos, exames de imagens, exame genético, biópsia muscular, dentre outros exames.
Assim sendo, é importante lembrar que os níveis de CPK devem ser interpretados em conjunto com outros sintomas e exames clínicos. E caso haja suspeita de Miopatia, é fundamental realizar uma avaliação médica completa com um especialista em doenças neuromusculares para obter um diagnóstico preciso. O médico irá considerar todos os aspectos clínicos e resultados de exames para chegar a um diagnóstico correto.
Buscando estar sempre conectado com as notícias relacionadas e de interesse dos portadores de mutação no gene RYR1, mais especificamente a Miopatia Congênita Centronuclear, que se trata da doença que me acomete, tomei conhecimento da recente pré-publicação científica, intitulada, “O Propofol liga-se diretamente e inibe o receptor 1 de rianodina do músculo esquelético (RYR1)”, versão postada em 12 de janeiro de 2024, na qual os pesquisadores, Thomas T. Joseph, MD, PhD¹, Weiming Bu, PhD¹, Omid Haji-Ghassemi, PhD², Yu Seby Chen, PhD², Kellie Woll, PhD², Paul D. Allen, MD, PhD⁴, Grace Brannigan, PhD³, Filip Van Petegem, PhD², Roderic G. Eckenhoff, MD¹, através de resultados obtidos em estudos e ensaios sugerem em seus relatos que o propofol, um agente anestésico intravenoso de curta ação, em concentrações clínicas, se liga ao receptor de rianodina tipo 1 (RYR1), inibindo sua abertura, podendo assim, prevenir as manifestações clínicas da Hipertermia Maligna (HM), mesmo com exposição a agentes desencadeantes como os anestésicos voláteis.
Confira a integra da publicação pelo seguinte link: https://www.biorxiv.org/content/10.1101/2024.01.10.575040v1.full
O receptor de rianodina tipo 1 (RYR1) desempenha um papel central na determinação de quando (tempo), e quanta (quantidade) força é produzida pelos músculos esqueléticos, que é necessária e essencial para movimentação do corpo e atividades físicas diárias dos indivíduos. Como principal canal de liberação de íon de cálcio (Ca²⁺) no retículo sarcoplasmático do músculo esquelético, a mutação genética no receptor de rianodina tipo 1 (RYR1), tem a ela subjacentes, algumas doenças ou distúrbios musculares, tais como a Miopatia Centronuclear, Miopatia Central Core, Miopatia Multi-Minicore, Desproporção Congênita do Tipo de Fibra, incluindo distúrbios como a Rabdomiólise por Esforço, e a Hipertermia Maligna (HM).
Em pacientes com a mutação no gene RYR1, “a crise” de Hipertermia Maligna, causada pela exposição a algumas drogas desencadeantes, como os anestésicos voláteis halogenados, pode direcionar o RYR1 a deixar o canal de rianodina em um estado aberto, resultando em uma liberação descontrolada de Ca²⁺, acarretando em tensão no sarcômero, e consequente produção de calor. A restauração de Ca²⁺ no retículo sarcoplasmático também consome ATP (adenosina trifosfato), molécula responsável pelo depósito de energia celular, gerando também por consequência uma carga metabólica adicional insustentável.
Ao anestesiar pacientes com mutações genéticas conhecidas pela suscetibilidade a Hipertermia Maligna, o anestésico geral intravenoso não desencadeante propofol é comumente substituído por anestésicos desencadeantes. As evidências de ligação direta de agentes anestésicos ao RYR1 ou seus parceiros de ligação são escassas, e as interações em nível atômico do propofol com o RYR1 são totalmente desconhecidas. Os pesquisadores mostram no trabalho acima descrito que o propofol diminui a abertura do receptor do canal de rianodina (RYR1) com vesículas no retículo sarcoplasmático e bicamadas lipídicas planas, e que inibe a liberação de Ca²⁺ induzida por ativador do retículo sarcoplasmático no músculo esquelético humano. Além de confirmar a ligação direta, a marcação por fotoafinidade usando m-azipropofol (AziPm) revelou vários supostos locais de ligação de propofol no RYR1. A projeção pela simulação dinâmica da afinidade de ligação molecular sugere que o propofol se liga a pelo menos um destes locais em concentrações clínicas. Esses achados convidam à hipótese de que, além de o propofol não desencadear a Hipertermia Maligna, ele também pode ser protetor contra a Hipertermia Maligna, inibindo o fluxo induzido de Ca²⁺ através do canal de rianodina - RYR1.
¹ Department of Anesthesiology and Critical Care, Perelman School of Medicine, University of Pennsylvania, Philadelphia, PA USA; ² Department of Biochemistry, University of British Columbia, Vancouver, BC, Canada; ³ Department of Physics and Center for Computational and Integrative Biology, Rutgers University, Camden, NJ USA; ⁴ Department of Anesthesiology, University of Tennesee, Knoxville, TN USA
O artigo acima mencionado foi publicado na bioRxiv, repositório aberto de pré-publicação direcionado as ciências biológicas (https://www.biorxiv.org/), e hospedado pelo Cold Spring Harbor Laboratory (CSHL).
As doenças relacionadas ao RYR1 são identificadas com base em sua classificação histopatológica, isto é, pela aparência da biópsia do músculo na lâmina do microscópio. A diferenciação encontrada na biópsia designará o tipo da doença, se é por exemplo, Miopatia Central Core, Miopatia Multiminicore, Miopatia Centronuclear, ou Desproporção Congênita de Tipos de Fibras.
A Miopatia Congênita Centronuclear (MCCN) e a Miopatia Central Core (MCC) são ambas doenças musculares hereditárias causadas por mutações genéticas. A MCCN pode estar associada a mutações em diferentes genes, no DNM2, BIN1, MTM1, e RYR1, já a MCC está associada somente ao gene RYR1.
Esses tipos de doenças relacionadas ao RYR1 variam amplamente em termos dos seus diferentes sinais e sintomas, de quando eles inicialmente se apresentaram, além da sua respectiva gravidade. Embora sejam altamente variáveis, os sintomas presentes também dependem se a mutação do gene RYR1 é autossômica dominante ou autossômica recessiva.
Uma pergunta que sempre chega até mim é sobre as diferenças entre a Miopatia Centronuclear e a Miopatia Central Core. Assim, eu, enquanto portador da Miopatia Congênita Centronuclear (MCN), buscarei esclarecer pontualmente neste texto, me atendo ao tipo que me acomete, que é a pela mutação no gene RYR1.
Estas doenças apesar de terem sintomas parecidos e compartilharem de algumas características clínicas em comum, se confundem entre si, e apresentam com algumas diferenças distintas:
Miopatia Congênita Centronuclear (MCCN)
Miopatia Central Core (MCC)
Em resumo, a Miopatia Congênita Centronuclear e a Miopatia Central Core, ambas doenças relacionada ao RYR1, têm seus sintomas e sinais físicos que podem se parecer, podem se confundir, mas são diferentes, a contar da análise histológica das células musculares em uma biópsia, exame este que é crucial para diferenciar entre as duas condições e determinar o diagnóstico correto, conduta médica, tratamento, e até prognóstico de evolução.
Nota: todo o material escrito nesta página é oriundo de pesquisa científica, e conclusões próprias do autor deste website, que convive como portador, desde o nascimento, com a Miopatia Congênita Centronuclear causada pela mutação no gene RYR-1
As miopatias são doenças que afetam os músculos, e podem se apresentar desde o nascimento até a idade adulta. Quando a miopatia se manifesta no início da vida, é frequentemente referida como miopatia congênita e de origem genética.
O diagnóstico de miopatia em uma criança geralmente envolve uma combinação de exame físico, história clínica, testes laboratoriais, incluindo biópsia e exame genético, além de exames de imagem. O diagnóstico preciso depende da avaliação completa feita por um médico especialista em doenças neuromusculares pediátricas.
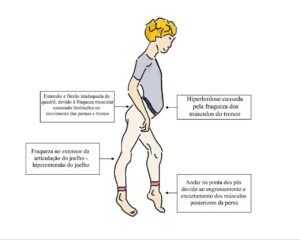
Existem alguns sinais físicos que são característicos em uma criança portadora de miopatia. Além do Movimento de Gowers, já descrito nesta website, o Sinal de Trendelenburg e a Marcha Miopática também são sinais físicos que podem ser cruciais no exame clínico quando do diagnóstico de uma miopatia. Esses sinais são incorporados como característica da doença, podendo ter um impacto significativo na qualidade de vida de quem a sofre, portanto, o acompanhamento e tratamento adequados são essenciais para ajudar os indivíduos a controlar os sintomas, limitações, evitar complicações secundárias, e manter uma boa qualidade de vida.
A Marcha Miopática é um termo médico usado para descrever um padrão de caminhada que é afetado pela fraqueza muscular causada por uma miopatia, que também é conhecida como Marcha do Pato. Essa condição provoca uma série de alterações na maneira de andar dos indivíduos afetados. Um dos sintomas mais característicos é também chamado de marcha bamboleante. Esta marcha é caracterizada pelo balanço do tronco e separação dos pés durante a caminhada. Como os músculos do tronco também são afetados, desencadeia-se uma postura anormal, apresentando como exemplo a hiperlordose lombar, que é uma curvatura excessiva na região lombar. Outra característica distintiva é andar na ponta dos pés, que provoca o espessamento e retração da musculatura posterior da perna, criando uma aparência de pseudo-hipertrofia. Nesta condição, os músculos tornam-se mais espessos e volumosos, mas na verdade é resultado da destruição da fibra muscular e da sua substituição por tecido fibroso ou fibras colágenas. Este padrão de marcha é uma característica comum em várias formas de miopatia e pode variar em gravidade dependendo do tipo e da progressão da doença.
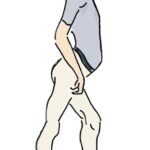
O Sinal de Trendelenburg é uma característica bem comum em indivíduos afetados por uma miopatia, com fraqueza da musculatura abdutora do quadril, em especial o glúteo médio. O nome deste sinal é em homenagem ao cirurgião alemão Friedrich Trendelenburg. O sinal de Trendelenburg é positivo se, quando o quadril de um paciente que está de pé sustentado por somente uma perna, cai para o lado da perna levantada. A fraqueza é presente no lado da perna em contato com o chão. O corpo não é capaz de manter a perna estável, causando uma inclinação ou queda da pelve em comparação com o lado contralateral. Essencialmente, o Sinal de Trendelenburg é causado pela fraqueza dos músculos glúteo médio e mínimo.
O Sinal de Trendelenburg e a Marcha Miopática, apesar de poderem variar dependendo da miopatia, e da forma que ela se apresenta em cada indivíduo, ao longo do tempo, podem desencadear uma série de consequências no corpo (ufa ! …e eu que o diga…), podendo relacionar algumas delas:
Nota: todo o material escrito nesta página é oriundo de pesquisa científica, e conclusões próprias do autor deste website, que convive como portador, desde o nascimento, com a Miopatia Congênita Centronuclear causada pela mutação no gene RYR-1
ARMGO PHARMA PÚBLICA IMPORTANTES E POSITIVOS RESULTADOS DO ENSAIO DE FASE 1B DO RYCALl® ARM210 PARA O TRATAMENTO DE MIOPATIAS RELACIONADAS AO RECEPTOR DE RIANODINA 1
ARMGO Pharma, Inc. (ARMGO), uma empresa privada no setor biofarmacêutico que desenvolve uma nova classe de drogas de moléculas pequenas ou micro moléculas conhecidas como Rycals®, anunciou em 29 de janeiro de 2024 a publicação dos resultados de um estudo de Fase 1b de seu Rycal ARM210 (também conhecido como S48168), para o tratamento de miopatias relacionadas ao receptor 1 de Ryanodina (RYR1-RM), uma doença muscular órfã, também chamada de “doença rara”, por ser uma doença que afeta uma pequena percentagem da população.
2024 a publicação dos resultados de um estudo de Fase 1b de seu Rycal ARM210 (também conhecido como S48168), para o tratamento de miopatias relacionadas ao receptor 1 de Ryanodina (RYR1-RM), uma doença muscular órfã, também chamada de “doença rara”, por ser uma doença que afeta uma pequena percentagem da população.
Os dados foram publicados em um artigo intitulado 'Rycal S48168 (ARM210) para Miopatias Relacionadas ao RYR1: um ensaio de fase um, estudo em aberto, e de ensaio de escalonamento de dose', de autoria do Dr. Joshua Todd et al, no Journal eClinicalMedicine, parte da família de publicações Lancet. O artigo revisa os dados do estudo de Fase 1b do ARM210 e seu novo mecanismo de ação alostérico (MoA) visando a causa raiz da doença relacionada ao RYR-1 (RYR1-RM): mutação do Receptor 1 de Ryanodina (RYR1).
O gene RYR1 que codifica o Receptor 1 de Ryanodina RYR1, um canal intracelular de liberação de cálcio, vaza em doenças musculares. Vazamentos intracelulares de cálcio causados por canais RYR1 com mutação prejudicam a contração muscular, levando à fraqueza muscular e perda de função, e ativam vias tóxicas que danificam os músculos, causando os sintomas das doenças relacionadas ao RYR1.
O ensaio de Fase 1b, aberto, de escalonamento de dose confirmou a segurança, tolerabilidade e farmacocinética da dosagem de 120 e 200 mg de ARM210 diariamente durante 29 dias em homens e mulheres adultos afetados pelas doenças relacionadas ao RYR1 (RYR1-RM).
É importante ressaltar que o estudo também demonstrou eficácia preliminar no grupo de dose mais alta em dois sintomas característicos das doenças relacionadas ao RYR1 (RYR1-RM): 1) alívio significativo da fadiga avaliada pelo sistema PROMIS-fatigue (Patient-Reported-Outcome Measurement Information System) t-scores, e 2) melhora da força dos proximais avaliada pelo exame físico de abdução do ombro (Medical Research Council Grading). Estes resultados justificam o desenvolvimento futuro do ARM210 como um potencial tratamento e modificador da doença para as miopatias relacionadas ao RYR1 (RYR1-RM) em um ensaio de Fase 2 randomizado e controlado por placebo.
O ensaio de Fase 1b concluído foi conduzido em colaboração com o National Institute of Neurological Disorders and Stroke (NINDS) e National Institute of Health (NIH) sob um Acordo Cooperativo de Pesquisa e Desenvolvimento (CRADA - Cooperative Research and Development Agreement ), com o apoio da Fundação RYR-1, Pittsburgh, PA, EUA.

(Foto esquerda para direita: Dr. Tokunbor Lawal (autor da publicação), Dr. Mike Goldberg (co-fundador/Co-presidente de Pesquisas da Fundação RYR-1), e Dr. Payam Mohassel (Pesquisador Principal e Autor Senior)).
“Estamos muito satisfeitos com os resultados do ensaio com as doenças relacionadas ao RYR1 (RYR1-RM) conduzido em conjunto com o NIH, pois o estudo confirmou a segurança e tolerabilidade do ARM210, mas o mais importante, demonstrou pela primeira vez que o nosso Rycal®, ARM210, pode reverter os sintomas desta doença muscular crônica e devastadora em um curto período de tratamento. Isso é muito promissor”, disse Gene Marcantonio, M.D., Ph.D., CEO da ARMGO Pharma. “Esperamos, portanto, continuar rapidamente no desenvolvimento do ARM210 para levar este primeiro e potencial tratamento aos pacientes com as doenças relacionadas ao RYR1, com o apoio da Fundação RYR-1 e da comunidade de pacientes.”
Michael F. Goldberg, MD, MPH, co-presidente de pesquisa da Fundação RYR-1 acrescentou: “Estamos entusiasmados com a publicação deste importante estudo, pois representa um farol de esperança para muitos indivíduos e famílias de todo o mundo afetados pelas doenças relacionadas ao RYR1. Estamos ansiosos pelas próximas etapas de ensaios no desenvolvimento dessa importante droga.”
Mais informações sobre este estudo de Fase 1b podem ser encontradas online em: https://clinicaltrials.gov/study/NCT04141670. O ensaio foi apoiado pelos Programas de Pesquisa Intramural do NIH/NINDS, NIH/NINR, um NIH Clinical Center Bench to Bedside Award (2017-551673) e pelo parceiro de colaboração anterior da ARMGO, Les Laboratoires Servier. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente a opinião oficial dos Institutos Nacionais de Saúde.
BREVE REVISÃO SOBRE A FUNÇÃO DO RYR1 E DOENÇAS RELACIONADAS
Os RYRs são canais homotetraméricos de liberação de cálcio intracelular responsáveis pelo fluxo de Ca2+ dos retículos sarcoplasmáticos/endoplasmáticos (RS/RE) para o citoplasma da maioria dos tipos de células. RYR1 é a isoforma predominante no músculo esquelético de mamíferos, onde a liberação de Ca2+ via RYR1 é necessária para o acoplamento excitação-contração e função muscular normal. Já o RYR2 é a isoforma predominante no músculo cardíaco onde a liberação de Ca2+ via RYR2 é necessária para a função normal do músculo cardíaco. Mutações genéticas humanas nos genes RYR1 e RYR2 fazem com que o cálcio vaze dos canais RYR, levando à doença (Figura 1).
Os canais RYR normalmente alternam entre um estado de repouso (fechado) e excitado (aberto). Em certas doenças, em que existe a mutação genética, o RYR é modificado e torna-se incontinente ou seja, fica vazando. No caso do RYR1, este desempenha um papel crítico no músculo esquelético, e as mutações do RYR1 em humanos levam a uma miopatia progressiva, conhecida como doenças relacionadas ao RYR1 (RYR1-RM), privando o músculo da capacidade de responder eficazmente aos sinais de contração, levando à fraqueza muscular.
Sobre o Rycals® - A inibição do canal interromperia o vazamento, mas esta intervenção geralmente não seria benéfica, uma vez que bloquearia a função normal do RYR. O Rycals®, são moléculas que podem restaurar a função normal do canal sem bloquear o RYR, e abrem a possibilidade de intervenções terapêuticas.
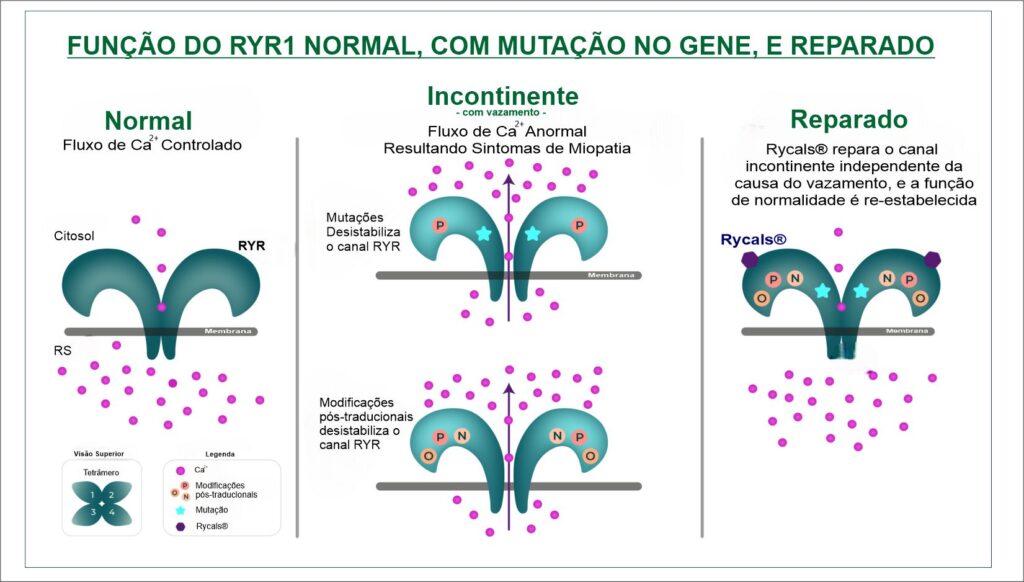
Figura 1: Modelo da função do RYR. O RYR controla o fluxo de cálcio (Ca2+) de dentro do retículo sarcoplasmático (RS) através da membrana até o citoplasma. (Quadro Esquerdo) O RYR normal regula o fluxo de cálcio alternando entre um estado fechado e aberto. (Quadro Meio) Na RYR1-RM, o RYR mutado apresenta vazamento, levando ao fluxo anormal de cálcio, resultando em sintomas da doença. Modificações pós-traducionais* (MPTs) do RYR agravam ainda mais o vazamento. Em outros distúrbios musculares, como DMD, insuficiência cardíaca ou sarcopenia, as modificações pós-traducionais (MPTs) do RYR podem causar vazamento no canal, levando a um fluxo anormal de cálcio, resultando em sintomas da doença. (Quadro Direito) Rycals® liga-se aos canais incontinentes (com vazamento) e repara o vazamento independentemente da causa do vazamento, restaurando a função normal do canal. O Rycals® não bloqueia o RYR.
*As modificações pós-traducionais (MPTs) são modificações químicas e estruturais de uma cadeia proteica após a sua tradução. Estas modificações podem determinar a atividade, a localização e interações com outras proteínas.

Em recente postagem na página do SorRYR-1 no Instagram (@sorryr_1) em que me caracterizei com pequenas frases, fui muito questionado sobre um termo utilizado nos EUA, #ambulatorywheelchairuser, mas que aqui no Brasil ainda não é muito conhecido, “Cadeirante Ambulatório”.
Indivíduos afetados por uma doença neuromuscular tem uma grande probabilidade de ter sua mobilidade limitada no decorrer do tempo, e essa situação pode evoluir de maneira gradativa ou repentinamente.
A maneira com que nós, pessoas com deficiência física (PCD), encaramos nossa situação e a forma que vivemos diante de nossas adversidades evoluíram muito nos últimos anos, assim como pela maneira que sociedade nos veem.
Para que essa evolução acontecesse alguns conceitos tiveram que ser inseridos em nosso dia a dia, como por exemplo a inclusão social, acessibilidade, capacitismo, enfim, mas alguns termos também tiveram que ser lançados para nos caracterizar melhor diante da sociedade, como por exemplo, “Cadeirante Ambulatório”.
Cadeirante Ambulatório refere-se a pessoas com deficiência física ou doença crônica que usam cadeira de rodas, embora possam ter alguma capacidade de andar em circunstâncias limitadas e particulares. Há muitas razões pelas quais uma pessoa pode ser um cadeirante ambulatório, sendo a principal para melhorar sua liberdade e a qualidade de vida. Outro termo importante destacar neste momento é que existe o cadeirante ativo e cadeirante passivo, sendo que o primeiro consegue por si mesmo tocar a rodas a cadeira de rodas, e o passivo depende outra pessoa.
Recentemente foi publicado um artigo médico-científico tratando sobre a Pancreatite em Indivíduos com Doenças Relacionadas ao RYR1. O estudo teve participação de pesquisadores do Reino Unido, Holanda e Estados Unidos, além do nobre apoio da Fundação RYR1.
Mutações no gene do receptor de rianodina do músculo esquelético (RYR1) são uma causa comum de doenças neuromusculares hereditárias e têm sido associadas a um amplo espectro de fenotípico, variando de várias miopatias congênitas de início precoce com fraqueza muitas vezes substancial, até fenótipos induzidos em indivíduos “normalmente fortes” tais como a Rabdomiólise por Esforço (ERM) e suscetibilidade aos efeitos relacionados à anestesia, como a Hipertermia Maligna (HM). O gene RYR1 codifica o principal canal de liberação de cálcio do retículo sarcoplasmático (SR) com um papel crucial
no acoplamento excitação-contração (ECC), processo pelo qual um impulso neuronal elétrico é traduzido em contração muscular por meio da liberação de cálcio intracelular, estimulando o filamento contrátil. Mutações no gene RYR1 associadas à fraqueza muscular permanente normalmente prejudicam o processo excitação-contração (ECC) de forma eficaz, enquanto aquelas associadas com ERM e MH resultam em um receptor RYR1 hiperexcitável e muitas vezes aumenta desproporcionalmente a liberação de cálcio.
Os genes RYR1s foram implicados em processos essenciais de sinalização de cálcio em uma ampla gama de tecidos, mas as manifestações de doenças humanas associadas ao mau funcionamento do RYR1 em outros órgãos além do músculo esquelético até agora receberam pouca atenção. Descobriu-se que os genes RYR1s são amplamente expressos no pâncreas de mamíferos, através de seu papel nos processos de sinalização de cálcio intracelular, e têm sido criticamente implicados na função pancreática endócrina e exócrina.
No estudo foi relatado três casos com características principais de um distúrbio relacionado ao RYR1 e uma história adicional de pancreatite (aguda) inexplicável, sugerindo uma nova associação clínica de função perturbada do RYR1 não relacionada ao músculo estriado. Os três pacientes com diagnóstico de Miopatia Central Core (CCD), Síndrome de King-Denborough (KDS) e Suscetibilidade à Hipertermia Maligna (MHS), respectivamente, que além de seu (suposto) distúrbio relacionado ao RYR1 também desenvolveram sintomas e sinais de pancreatite aguda. Em dois pacientes, os episódios foram recorrentes, com grave envolvimento multissistêmico e sequelas. A sinalização de cálcio mediada por RYR1 desempenha um papel importante na função pancreática normal, mas também tem sido criticamente implicada na fisiopatologia da pancreatite aguda, particularmente nas formas induzidas por ácidos biliares e etanol. Os resultados de modelos animais relevantes indicam que os danos pancreáticos nestas condições podem ser melhorados através da administração do antagonista específico de RYR1, dantroleno, e de outros compostos que modificam o metabolismo pancreático, incluindo a sinalização de cálcio. Estas observações sugerem que os pacientes com variantes de ganho de função do RYR1 podem ter um risco aumentado de desenvolver pancreatite aguda, uma condição que deve, portanto, ser considerada na vigilância da saúde desses indivíduos.
Saiba mais detalhes sobre o tema
deste texto lendo a publicação
completa no artigo científico
clicando na imagem ao lado ⇒