A grande maioria das pessoas a partir dos 50 anos se deparam com complicações ortopédicas, seja nas articulações, coluna, quadril, dentre outros, e isso geralmente se deve pelo uso inadequado do corpo gerando os desgastes naturais que acontecem no decorrer da vida, ou acontece também pela falta de exercícios físicos.
No caso do indivíduo portador de miopatia centronuclear, doença essa causada pela mutação no gene RYR-1, responsável pelo funcionamento dos músculos, as implicações ortopédicas em relação a uma pessoa sem a doença, é potencializada, e pode levar a uma série de complicações já desde o nascimento. Como já explicado em postagens anteriores, cada pessoa com doença relacionada ao RYR-1 é única, assim como a evolução da doença, as complicações também podem afetar diferentemente cada indivíduo.
Nesta postagem, vou discorrer sobre alguns dos principais problemas ortopédicos com os quais pessoalmente convivo, e que podem ocorrer com os indivíduos afetados por uma doença relacionada ao RYR-1, que são:
 nas articulações e tendões. No nosso caso, portadores de miopatia, a situação é logicamente agravada, porque como nossos músculos não são utilizados adequadamente, o enfraquecimento muscular é aumentado, resultando em instabilidade nas articulações, e isso pode aumentar o risco de lesões, como distensões ou rupturas de tendões. Além disso, a imobilidade por fraqueza muscular pode levar à rigidez articular e à perda de amplitude de movimento, o que pode causar dor e desconforto. Essa falta de mobilidade muscular também pode contribuir para o desenvolvimento de condições como a artrite, pois as articulações não recebem o movimento necessário para manter a saúde e a lubrificação adequada.
nas articulações e tendões. No nosso caso, portadores de miopatia, a situação é logicamente agravada, porque como nossos músculos não são utilizados adequadamente, o enfraquecimento muscular é aumentado, resultando em instabilidade nas articulações, e isso pode aumentar o risco de lesões, como distensões ou rupturas de tendões. Além disso, a imobilidade por fraqueza muscular pode levar à rigidez articular e à perda de amplitude de movimento, o que pode causar dor e desconforto. Essa falta de mobilidade muscular também pode contribuir para o desenvolvimento de condições como a artrite, pois as articulações não recebem o movimento necessário para manter a saúde e a lubrificação adequada.
Para concluir, eu diria que as complicações ortopédicas acima descritas podem ser inevitáveis aos portadores de miopatias relacionadas ao RYR1, sejam elas por origem congênita, ou em decorrência das adaptações que o indivíduo precisa fazer para conseguir movimentar durante a vida, ou pelas que acontecem com o desgaste natural do envelhecimento. Como portador de Miopatia Congênita Centronuclear, eu convivo com todas as complicações descritas, e de todas as origens de causas. Contudo, vejo que existem formas de se prevenir, postergar o seu surgimento ou agravamento, e até de se mitigar os sintomas das complicações ortopédicas. A educação postural, e o desenvolvimento pessoal de consciência corporal, devem fazer parte do nosso dia a dia. No caso de as complicações já terem se instaladas, o manejo desses problemas geralmente envolve uma combinação de fisioterapia, alongamentos, terapia ocupacional e, em alguns casos as intervenções cirúrgicas para corrigir deformidades ou melhorar a função do corpo. Por fim, é fundamental que os portadores de miopatia centronuclear sejam acompanhados por uma equipe multidisciplinar para abordar essas questões de forma abrangente, preventiva e terapêutica.
As miopatias são doenças que afetam os músculos, e podem se apresentar desde o nascimento até a idade adulta. Quando a miopatia se manifesta no início da vida, é frequentemente referida como miopatia congênita e de origem genética.
O diagnóstico de miopatia em uma criança geralmente envolve uma combinação de exame físico, história clínica, testes laboratoriais, incluindo biópsia e exame genético, além de exames de imagem. O diagnóstico preciso depende da avaliação completa feita por um médico especialista em doenças neuromusculares pediátricas.
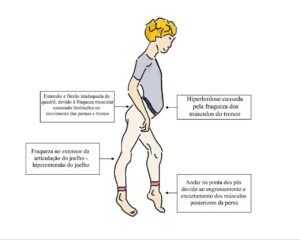
Existem alguns sinais físicos que são característicos em uma criança portadora de miopatia. Além do Movimento de Gowers, já descrito nesta website, o Sinal de Trendelenburg e a Marcha Miopática também são sinais físicos que podem ser cruciais no exame clínico quando do diagnóstico de uma miopatia. Esses sinais são incorporados como característica da doença, podendo ter um impacto significativo na qualidade de vida de quem a sofre, portanto, o acompanhamento e tratamento adequados são essenciais para ajudar os indivíduos a controlar os sintomas, limitações, evitar complicações secundárias, e manter uma boa qualidade de vida.
A Marcha Miopática é um termo médico usado para descrever um padrão de caminhada que é afetado pela fraqueza muscular causada por uma miopatia, que também é conhecida como Marcha do Pato. Essa condição provoca uma série de alterações na maneira de andar dos indivíduos afetados. Um dos sintomas mais característicos é também chamado de marcha bamboleante. Esta marcha é caracterizada pelo balanço do tronco e separação dos pés durante a caminhada. Como os músculos do tronco também são afetados, desencadeia-se uma postura anormal, apresentando como exemplo a hiperlordose lombar, que é uma curvatura excessiva na região lombar. Outra característica distintiva é andar na ponta dos pés, que provoca o espessamento e retração da musculatura posterior da perna, criando uma aparência de pseudo-hipertrofia. Nesta condição, os músculos tornam-se mais espessos e volumosos, mas na verdade é resultado da destruição da fibra muscular e da sua substituição por tecido fibroso ou fibras colágenas. Este padrão de marcha é uma característica comum em várias formas de miopatia e pode variar em gravidade dependendo do tipo e da progressão da doença.
O Sinal de Trendelenburg é uma característica bem comum em indivíduos afetados por uma miopatia, com fraqueza da musculatura abdutora do quadril, em especial o glúteo médio. O nome deste sinal é em homenagem ao cirurgião alemão Friedrich Trendelenburg. O sinal de Trendelenburg é positivo se, quando o quadril de um paciente que está de pé sustentado por somente uma perna, cai para o lado da perna levantada. A fraqueza é presente no lado da perna em contato com o chão. O corpo não é capaz de manter a perna estável, causando uma inclinação ou queda da pelve em comparação com o lado contralateral. Essencialmente, o Sinal de Trendelenburg é causado pela fraqueza dos músculos glúteo médio e mínimo.
O Sinal de Trendelenburg e a Marcha Miopática, apesar de poderem variar dependendo da miopatia, e da forma que ela se apresenta em cada indivíduo, ao longo do tempo, podem desencadear uma série de consequências no corpo (ufa ! …e eu que o diga…), podendo relacionar algumas delas:
Nota: todo o material escrito nesta página é oriundo de pesquisa científica, e conclusões próprias do autor deste website, que convive como portador, desde o nascimento, com a Miopatia Congênita Centronuclear causada pela mutação no gene RYR-1
A terapia genética que era tida como uma futura grande promessa para o tratamento de miopatias relacionadas ao RYR1, se torna uma realidade com a publicação do recente relato científico da primeira correção por Edição Prime de uma mutação no gene RYR1.
A Fundação RYR-1 (https://ryr1.org/) cumprimentou a todos no início de ano com um “Feliz 2024, mas também compartilhou a informação que financiou uma pesquisa incrivelmente importante com o Dr. Jacques P. Tremblay, um pesquisador na Universidade Laval em Quebec. As descobertas e resultados dos trabalhos de pesquisa acabaram de ser publicadas em um novo artigo de  pesquisa (https://www.mdpi.com/2073-4409/13/1/31#). E o resultado é ainda mais emocionante, pois os pesquisadores utilizaram com sucesso a Edição Prime, uma forma de edição genética, que foi utilizada para corrigir uma mutação no gene RYR1 nas células musculares esqueléticas. Esta pesquisa fornece "prova de conceito" para a edição de genes como sendo uma estratégia em potencial para tratar miopatias relacionadas com RYR-1, que atualmente carecem de terapias eficazes. Segundo o cientista, "estes resultados são as primeiras demonstrações de que é possível corrigir mutações no gene RYR-1"
pesquisa (https://www.mdpi.com/2073-4409/13/1/31#). E o resultado é ainda mais emocionante, pois os pesquisadores utilizaram com sucesso a Edição Prime, uma forma de edição genética, que foi utilizada para corrigir uma mutação no gene RYR1 nas células musculares esqueléticas. Esta pesquisa fornece "prova de conceito" para a edição de genes como sendo uma estratégia em potencial para tratar miopatias relacionadas com RYR-1, que atualmente carecem de terapias eficazes. Segundo o cientista, "estes resultados são as primeiras demonstrações de que é possível corrigir mutações no gene RYR-1"
O gene RYR1 codifica um canal de cálcio denominado receptor 1 de Ryanodina, apresentada nas fibras musculares esqueléticas. A falha desse canal causa fraqueza muscular, que degenera acarretando deficiências motoras no indivíduo afetado. Atualmente, não existem tratamentos eficazes para estas miopatias, também conhecidas como doenças relacionadas ao RYR1, que são causadas principalmente por mutações pontuais. A Edição Prime permite a modificação precisa de nucleotídeos no DNA. Os resultados dos trabalhos de pesquisa pelos cientistas Kelly Godbout, Joël Rousseau e Jacques P. Tremblay, demostraram uma taxa de correção de 59% da mutação T4709M no gene RYR1 em mioblastos humanos pela entrega de RNA dos componentes de Edição Prime. Deve-se notar que o T4709M é recessivo e, portanto, as pessoas com mutação heterozigótica são saudáveis. Estes resultados são a primeira demonstração de que é possível corrigir mutações no gene RYR1.
A tecnologia de Edição Prime pode ser usada para corrigir mutações que causam miopatias relacionadas ao RYR1. Este grupo de doenças inclui a Hipertermia Maligna (HM), Miopatia Central Core (CCD), Miopaty Multi-Minicore (MmD), Miopatia Centronuclear (CNM), Desproporção Congênita do Tipo de Fibra (CFTD) e Rabdomiólise por Esforço (ERM). Até o momento, mais de 700 variantes no gene RYR1 foram identificadas. Este gene que codifica uma proteína chamada "receptor de rianodina 1" (RyR1), é o principal canal de cálcio no retículo sarcoplasmático (SR) nas fibras musculares esqueléticas. A disfunção desta proteína afeta o fluxo de cálcio para os músculos. A posição da mutação não afetará ou impactará na proteína, mas as mutações nos genes farão com que ocorra principalmente a um vazamento de cálcio. E como o cálcio é fundamental para a contração muscular, essa desregulação do RYR1 leva à fraqueza muscular, caibras, exaustão, intolerância ao calor, dificuldades respiratórias e até mesmo à reação maligna de hipertermia, ou Hipertermia Maligna. Essas miopatias, portanto, afetam gravemente a qualidade de vida dos pacientes. A proteína RYR1 tem variações funcionais limitadas, e o gene RYR1 é um dos mais intolerantes a variações de sequência no genoma humano.
Até o momento, não existe tratamento eficaz para essas doenças relacionadas ao RYR1. Como muitas mutações nos genes RYR1 são mutações pontuais, os resultados descritos no referido artigo demonstram claramente que a Edição Prime pode ser utilizada para corrigi-las, uma vez que pode substituir qualquer nucleotídeo do genoma.
O referido artigo relata a correção de uma dessas mutações (isto é, a T4709M) como exemplo. Esta mutação específica foi selecionada porque existe um modelo de camundongo (RYR1TM/Indel) com essa mutação que desenvolve sintomas claros. Confira o artigo científico no link -> https://www.mdpi.com/2073-4409/13/1/31#
TERAPIA GENÉTICA
A terapia genética é uma grande promessa para o tratamento de doenças genéticas, uma vez que aborda diretamente a raiz do problema. Ao corrigir mutações, a terapia genética tem o potencial de curar milhares de doenças hereditárias.
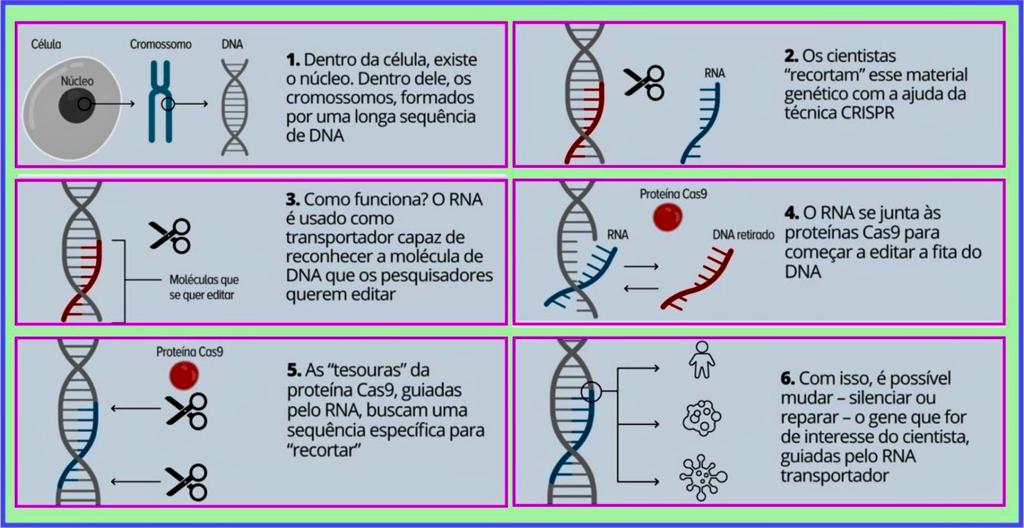
A descoberta do CRISPR/Cas9 em 2012 foi um marco no desenvolvimento de terapias genéticas. O Crispr/Cas9 é uma espécie de "tesoura genética", que permite à ciência mudar parte do código genético de uma célula. Com essa "tesoura", é possível, por exemplo, "cortar" uma parte específica do DNA, fazendo com que a célula produza ou não determinadas proteínas.
Este sistema usa uma nuclease Cas9 que induz uma quebra da fita dupla do DNA em um local preciso do genoma. Cas9 é direcionado para a sequência do genoma desejada por um único RNA guia (sgRNA). Este sgRNA é um RNA de fita simples complementar a uma sequência de DNA. A proteína Cas9 forma um complexo com o sgRNA e se liga a um motivo adjacente no DNA, induzindo um corte. Após a quebra da cadeia dupla no local do desejado, a célula irá reparar este corte por Reparação Dirigida por Homologia (HDR) se for fornecida uma sequência doadora. No entanto, a percentagem de correção de uma mutação precisa de nucleótidos por HDR é demasiado baixa para ser utilizada no tratamento de doenças hereditárias in vivo . Se nenhuma sequência doadora for fornecida, a célula reparará o corte por junção final não homóloga (NHEJ) e produzirá indels. InDels (inserções e deleções) são adições ou perdas de uma ou mais bases consecutivas na sequência do DNA.
CRISPR/Cas9
Em outubro de 2019, o grupo de David R. Liu publicou uma técnica notável chamada PRIME EDITION. Este sistema pode realizar inserções, deleções direcionadas e todas as 12 conversões de base possíveis.
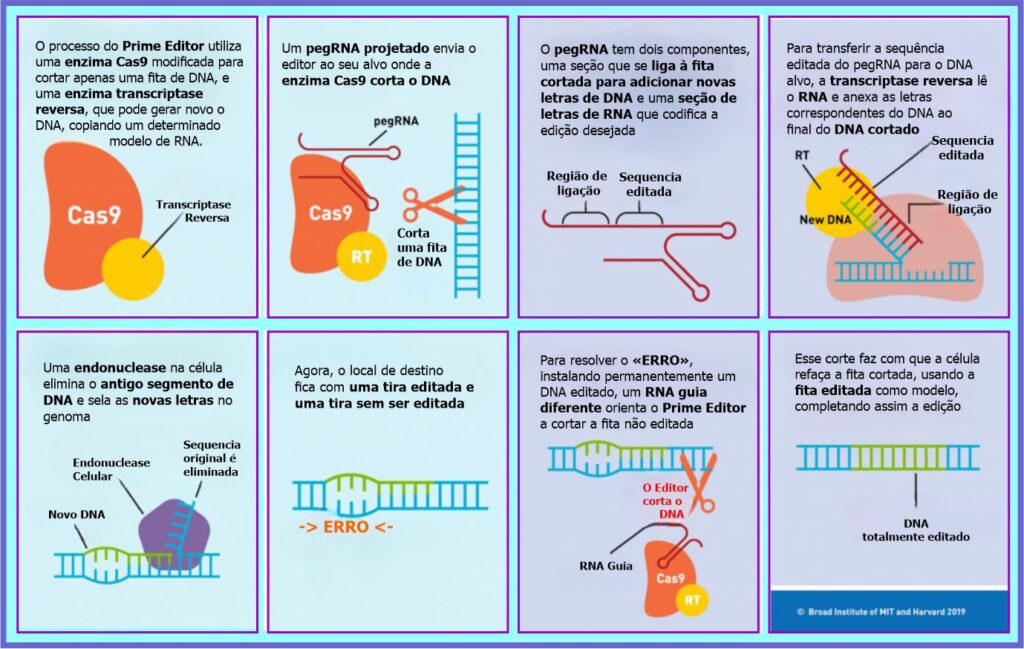
O Prime Edition ou sistema Edição Prime (em português), é um método de edição de genoma que grava diretamente novas informações genéticas em um local (endereço) de DNA especificado usando uma endonuclease Cas9 prejudicada cataliticamente e fundida com uma transcriptase reversa projetada, programada com um RNA de guia Prime Edition (pegRNA) que especifica o local de destino e codifica a edição desejada. Esta tecnologia realiza modificações no DNA com precisão sem precedentes e oferece vantagens substanciais sobre o sistema tradicional CRISPR/Cas9.
Prime Editing é mais complexo que a edição CRISPR. Ele pode excluir comprimentos longos de DNA causador de doença ou inserir DNA para reparar mutações perigosas, tudo sem desencadear as respostas caóticas (e possivelmente prejudiciais) do genoma introduzidas por outras formas de CRISPR.
Prime Edition
Em resumo, a técnica CRISPR-Cas9, popularmente utilizada para modificação genética pela comunidade científica, baseia-se na atividade nuclease da enzima Cas9 que corta as duas fitas de DNA, e utiliza a maquinaria de reparo de danos da própria célula. No entanto, o sistema de reparo pode inserir ou deletar letras de DNA, causando efeitos inesperados. Já a nova tecnologia “Prime Editing” ou Edição Prime utiliza uma versão enzima Cas9 que além de reconhecer sequências específicas de DNA, corta apenas uma das fitas da dupla-hélice. Dessa forma, a edição ocorre no local correto do corte através da ação de uma enzima transcriptase e uma fita de RNA guia (pegRNA).
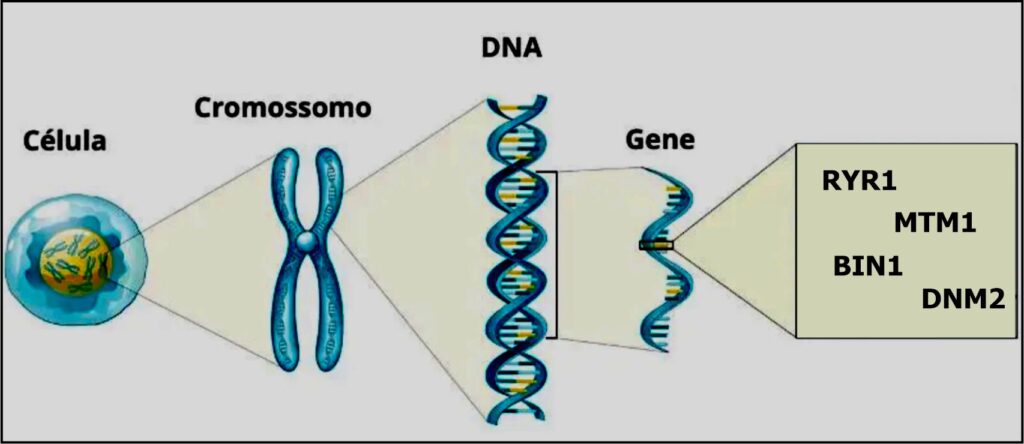
A Miopatia Congênita Centronuclear (MCCN) é uma doença muscular congênita rara caracterizada por fibras celulares com núcleos centralizados proeminentes em biópsias musculares. A doença é clinicamente heterogênea, variando de fenótipos hipotônicos graves já no nascimento até fraqueza muscular leve com início na idade adulta, e pode ter múltiplos modos de herança em associação de causa por mutações nos genes MTM1, DNM2, BIN1 e RYR1.
Assim como existe uma grande complexidade no diagnóstico de uma miopatia, tema esse abordado em outra postagem no SORRYR-1.com.br, essas diferentes causas, são também motivo de grande confusão em diagnósticos. É importante consultar um médico especialista para um diagnóstico preciso e assim obter informações detalhadas sobre a mutação específica no caso individual. As diferentes mutações genéticas que causam a Miopatia Congênita Centronuclear podem resultar em variações na gravidade, evolução e sintomas da doença. É importante dizer que a gravidade dos sintomas da doença pode variar de pessoa para pessoa, mesmo com a mesma mutação genética.
Seguem as diferentes causas de origem da Miopatia Congênita Centronuclear (MCCN):
O gene MTM1 é responsável pela codificação de proteína chamada miotubularina. Essa proteína desempenha um papel importante na função muscular, fundamental por atuar como uma enzima fosfatase de desempenho crítico na regulação do tráfego de vesículas dentro das células musculares, particularmente nas fibras musculares esqueléticas. Quando há uma mutação no gene MTM1, a produção ou função da miotubularina é afetada, e sso pode resultar em um acúmulo anormal de vesículas dentro das fibras musculares, levando à fraqueza muscular e outros sintomas associados à Miopatia Congênita Centronuclear.
A dinamina 2, codificada pelo gene DNM2, desempenha um papel crucial na regulação do tráfego de vesículas que transportam proteínas essenciais para a função muscular normal. Ela ajuda a controlar a fusão e divisão dessas vesículas, permitindo a entrega adequada de proteínas contráteis, como a miosina e actina, aos locais onde são necessárias para a contração muscular.
Quando ocorrem mutações no gene DNM2, a função da dinamina 2 pode ser comprometida, resultando em distúrbios que pode levar a fraqueza muscular, em especial nos músculos proximais, e outros sintomas associados a condições da MCCN. Portanto, a dinamina 2 desempenha um papel importante na manutenção da função muscular saudável.
O gene BIN1 codifica a proteína anexina A2, que está envolvida na regulação das membranas celulares e no tráfego de vesículas nas células musculares. Essas funções desempenhadas pela anexina A2 são essenciais para a saúde e a função das fibras musculares, a mutação nesse gene afeta negativamente a estrutura e a função das células musculares, o que resulta em fraqueza muscular e outros sintomas associados à CCNM. A gravidade e a apresentação dos sintomas podem variar com base na mutação específica do gene BIN1 envolvida.
O gene RYR1 codifica o receptor de rianodina 1, que é uma proteína essencial para a função das fibras musculares. O receptor de rianodina está envolvido na liberação (válvula de controle) de cálcio das reservas intracelulares, um processo fundamental para a contração e relaxamento muscular.
As doenças musculares são aquelas que afetam a estrutura e funcionamento do músculo, sendo as principais: as distrofias musculares, as miopatias congênitas, as miopatias inflamatórias e as miopatias endócrinas e metabólicas. É importante destacar que cada uma delas possui suas variações que também se diferenciam.
Essas doenças já foram muito confundidas em diagnósticos no passado, e fico triste, porque isso ainda tem acontecido nos dias de hoje, mesmo com os avanços científicos. A única razão que acredito ser ainda a causa para essa confusão nesses diagnósticos seria por essas doenças serem consideradas “doenças raras”, portanto, muitas vezes desconhecidas por parte da comunidade médica. Assim, pode haver a falha no momento dos exames clínicos, ponto inicial para diagnóstico de qualquer doença.
Eu mesmo vivi uma experiência dessa, pois no decorrer de grande parte da minha vida eu recebi vários “diagnósticos” de Distrofia Muscular Congênita (DMC) do tipo: Duchenne, Facioescapuloumeral e Cinturas. E, os prognósticos foram do pior a até o mais brando. Estes diagnósticos ou hipóteses de diagnósticos vieram até de importantes instituições, como de uma clínica indicada pelo MDA (Muscular Distrophy Association), maior referência ligada a essa doença.
Deve-se levar em consideração que, naquela época, pouco se sabia sobre essa doença, nem tão pouco sobre a genética humana; contudo, um erro de diagnóstico hoje em dia seria inaceitável. Essa situação causou em mim grandes transtornos, de emocional aos físicos. Somente aos 44 anos de idade foi que finalmente obtive meu correto e “definitivo diagnóstico”, ou seja, de que sou portador de Miopatia Congênita Centronuclear (MCC), causada pela mutação no gene RYR1.
A Distrofia Muscular Congênita e a Miopatia Congênita Centronuclear apresentam várias características em comum, tais como: são doenças de origem genética, afetam os músculos esqueléticos, caracterizam-se clinicamente por hipotonia e fraqueza muscular, geralmente apresentam-se desde o nascimento, têm curso clínico estático ou lentamente progressivo. Essas doenças não tem cura, e o tratamento envolve terapia de suporte, como fisioterapia, dispositivos de mobilidade e, em alguns casos, medicamentos. Mesmo assim, as duas doenças neuromusculares diferem entre si.
Daí, eu volto com a questão sobre as falhas nos diagnósticos, já que muitos médicos se prendem somente ao resultado do exame genético e não conhecerem os sinais clínicos das diferentes doenças e particularidades dos indivíduos afetados.
Assim, essas noções devem ser levadas em consideração por três razões: Primeiro, muitas das miopatias congênitas podem ser causadas por mutações em mais de um gene, o que sugere um impacto da heterogeneidade genética. Segundo, mutações no mesmo gene podem causar diferentes patologias musculares. Terceiro, a mesma mutação genética pode levar a diferentes características patológicas e sintomatológicas em membros da mesma família ou no mesmo indivíduo em idades diferentes.
Em resumo, eu destacaria que tanto a Distrofia Muscular, quanto a Miopatia Congênita Centronuclear são de origem genética, mas distintas em termos de suas características clínicas e podem variar em gravidade de pessoa para pessoa. Enquanto a Distrofia Muscular envolve a degeneração progressiva dos músculos devido a problemas na estrutura das proteínas musculares, a Miopatia Congênita Centronuclear é caracterizada por uma anormalidade na localização dos núcleos das células musculares. Assim, é importante consultar um médico especialista para um diagnóstico preciso, para que se possa ser feito um acompanhamento adequado do caso, pois o tratamento pode variar dependendo da condição clínica específica de cada indivíduo.
OS INDIVIDUOS PORTADORES DE DOENÇAS RELACIONADAS AO RYR-1 DEVEM ESTAR SEMPRE ATENTOS ÀS EVENTUAIS E POSSÍVEIS COMPLICAÇÕES CAUSADAS PELA DOENÇA
Como já dito anteriormente, não existe um tratamento específico para as doenças relacionadas ao RYR-1, e toda conduta médica diante do indivíduo afetado depende da etiologia, e sintomatologia de manifestação da doença, tendo sempre em vista as possíveis e eventuais complicações causadas pela doença. A morbidade e mortalidade de pessoas afetadas por miopatias relacionadas ao RYR-1 estão diretamente relacionadas à gravidade da doença, bem como à presença de outras comorbidades. As complicações mais comuns das miopatias relacionadas ao RYR-1 são as com questões respiratórias, ortopédicas, dentre outras.
Complicações Respiratórias
Dentre os diversos sistemas que temos em nosso corpo e que faz o organismo humano estar em funcionamento, destaca-se o sistema respiratório, para todos, de importância vital. Seu funcionamento depende diretamente de alguns músculos, dentre eles, dois diafragmas (músculos entre os pulmões e o abdome), os músculos entre as costelas, e os músculos no pescoço e garganta. As doenças neuromuscular podem causar a fraqueza destes músculos, os fazendo cansados e fatigados, difícultando assim a inspiração e expiração de maneira efeitiva. O funcionamento respiratório ineficaz pode abaixar a oxigenação e elevar os níveis de gás carbônico no seu sangue, fazendo assim com que os músculos fiquem ainda mais fracos, criando assim um ciclo vicioso,totalmente nocivo ao doente.
Assim como dentre outros sintomas, as complicações causadas pelas doenças relacionadas ao RYR-1, as respiratórias estão entre as mais comuns, e podem variar conforme a gravidade da doença. Alguns indivíduos podem não ter problema algum, outros podem ter problemas leves, mas que precisam de ajuda para respirar enquanto dormem ou quando estão doentes, e em casos graves, podem precisar de um ventilador para ajudá-los a respirar durante todo tempo. Portanto, dependendo do acometimento da doença no indivíduo, os médicos costumam fazer o acompanhamento do sistema respiratório regularmente.
O teste de função pulmonar (TFP) é uma forma de o pneumologista avaliar a presença, tipo e gravidade dos problemas respiratórios de alguém.
A polissonografia, ou “estudo do sono”, é feito para identificar, diagnosticar e tratar distúrbios do sono, causados por complicações no relaxamento dos músculos da garganta, situação esta, comum nos indivíduos afetados pelas miopatias causadas pelo RYR-1. O exame é feito durante o sono, totalmente indolor e não invasivo, e pode ser capaz de identificar por exemplo, a apneia obstrutiva do sono (obstrução temporária ou completa da respiração durante o sono) ou insuficiência respiratória (incapacidade de inalar oxigênio suficiente e exalar dióxido de carbono suficiente). Outra abordagem médica visando a prevenção e administração de complicações de problemas respiratórios associados à doenças causadas pelo RYR-1, são as imunizações com vacinas contra gripe, pneumonia, e qualquer outro virus que pode afetar o sistema respiratório, e a fisioterapia visando ajudar na tosse, com técnicas para facilitar a limpeza do muco, assim como para o tratamento da apneia do sono.
Complicações Ortopédicas
As complicações ortopédicas de natureza das doenças neuromusculares são bastantes comuns, tanto por desenvolvimento secundário ao desequilíbrio muscular, como por causa de trauma, distúrbios do nascimento, ou de caráter degenerativo. As complicações ortopédicas mais comuns entre pessoas afetadas por uma doença relacionada ao RYR-1 são: fraqueza, contraturas, luxações do quadril, escoliose, e outras deformidades da coluna vertebral.
A contratura muscular ocorre quando o músculo se contrai de maneira incorreta, seja por este estar muito fraco ou muito curto, não voltando assim ao seu estado normal de relaxamento. A contratura pode levar uma articulação não ter toda a sua amplitude de movimento, a tornando fixa ou rígida, promovendo a substituição do músculo por tecido conjuntivo rígido, ocasionando assim problemas com a cápsula articular, até deformidades físicas. O especialista médico, no caso o ortopedista, precisa determinar a causa da contratura para assim determinar a melhor forma de tratá-la, que pode ser através da fisioterapia, e utilização de órteses.
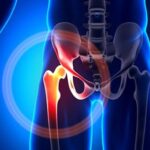
Luxação do quadril significa que o osso do quadril (fêmur) se posiciona de fora de sua junta ou fora de seu encaixe. Na maioria dos casos, o deslocamento ou luxação do quadril não interfere na capacidade de andar da pessoa. Não existe nenhuma regra padrão no tratamento de luxações do quadril em pessoas com doenças neuromusculares, e esta abordagem dependerá da idade do paciente, se existe controle e força muscular suficiente para apoiar o quadril, se o deslocamento afeta um ou ambos os lados, se o deslocamento afeta o dia a dia do indivíduo, e lhe cause sintomas como a dor. As luxações de quadril podem ser tratadas com a utilização de tala ou dispositivo semelhante. Contudo, caso isso não consiga controlar o deslocamento, especialistas poderão considerar a cirurgia.
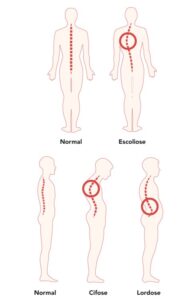
As deformidades na coluna vertebral mais comuns em pacientes afetados por uma miopatia relacionada ao RYR-1, é a Escoliose, que se trata de uma curva lateral da coluna vertebral, a Cifose que é a coluna curva muito para trás (“corcunda”), e a Lordose, que é a coluna curva muito para frente (“arqueada voltar"). Essas deformidades, têm como causa a fraqueza muscular, e deficiência de mobilidade, e podem piorar com a idade do indivíduo. As deformidades da coluna vertebral podem fazer com que a parede torácica se torne estreita ao ponto de interferir no funcionamento dos pulmões e diafragma, no equilíbrio, capacidade de movimentação dos braços, assim como na qualidade de vida do indivíduo. Um importante ponto de atenção e preocupação para o indivíduo afetado por uma miopatia causada pelo RYR-1, dado à fraqueza dos músculos respiratórios, é a Síndrome da Insuficiência Torácica, que é uma condição em que o tórax não consegue suportar a respiração ou crescimento do pulmão. No caso do paciente apresentar qualquer sinal de deformidade na coluna vertebral, é muito importante o acompanhamento vigilante de um ortopedista ou neurologista, que buscará o seu não agravamento, através da indicação de um trabalho de reeducação postural, mas sobretudo a fisioterapia funcional e respiratória.
Indivíduos portadores de doença relacionada com RYR-1, além de complicações respiratórias, e ortopédicas, podem também desenvolver problemas com músculos oculares, mastigação, deglutição e respiração, fraqueza muscular podendo ser de consequências leve a severa, a até a uma potencial reação fatal a certas formas de anestesia conhecidas como Hipertermia Maligna. A Hipertermia Maligna ocorre em indivíduos suscetíveis a este tipo de reação, como em aqueles afetados por mutação no RYR-1, e acontece como uma resposta do corpo a certos gases anestésicos e a um certo tipo de relaxante muscular usado para bloquear a sensação de dor, utilizado durante um procedimentos de anestesias em salas de cirurgia, salas de emergência e unidades de terapia intensiva (UTI). A Hipertermia Maligna é uma reação do corpo em que pode apresentar rigidez muscular, deterioração das fibras musculares (rabdomiólise), superaquecimento do corpo (febre alta), aumento dos níveis de ácido no sangue e outros tecidos (acidose), aumento da frequência cardíaca, e se o paciente não for tratado a tempo, HM pode resultar em insuficiência renal, cérebro danos, parada cardíaca, falência de órgãos adicionais e até morte. Existem atualmente algumas drogas específicas que são conhecidas por desencadear a Hipertermia Maligna, que são: (halotano, enflurano, isoflurano, sevoflurano e desflurano) e, provavelmente, succinilcolina. A sugestão preventiva que se dá a um indivíduo suscetível a esta reação, é comunicar aos seus familiares, pessoas de sua convivência, plano de saúde, além de fixar avisos em seus documentos pessoais, aparelho de celular, com a informação de advertência sobre o risco eminente da Hipertermia Maligna, destacando o nome das drogas a serem evitadas em caso de emergência.