ARMGO PHARMA PÚBLICA IMPORTANTES E POSITIVOS RESULTADOS DO ENSAIO DE FASE 1B DO RYCALl® ARM210 PARA O TRATAMENTO DE MIOPATIAS RELACIONADAS AO RECEPTOR DE RIANODINA 1
ARMGO Pharma, Inc. (ARMGO), uma empresa privada no setor biofarmacêutico que desenvolve uma nova classe de drogas de moléculas pequenas ou micro moléculas conhecidas como Rycals®, anunciou em 29 de janeiro de 2024 a publicação dos resultados de um estudo de Fase 1b de seu Rycal ARM210 (também conhecido como S48168), para o tratamento de miopatias relacionadas ao receptor 1 de Ryanodina (RYR1-RM), uma doença muscular órfã, também chamada de “doença rara”, por ser uma doença que afeta uma pequena percentagem da população.
2024 a publicação dos resultados de um estudo de Fase 1b de seu Rycal ARM210 (também conhecido como S48168), para o tratamento de miopatias relacionadas ao receptor 1 de Ryanodina (RYR1-RM), uma doença muscular órfã, também chamada de “doença rara”, por ser uma doença que afeta uma pequena percentagem da população.
Os dados foram publicados em um artigo intitulado 'Rycal S48168 (ARM210) para Miopatias Relacionadas ao RYR1: um ensaio de fase um, estudo em aberto, e de ensaio de escalonamento de dose', de autoria do Dr. Joshua Todd et al, no Journal eClinicalMedicine, parte da família de publicações Lancet. O artigo revisa os dados do estudo de Fase 1b do ARM210 e seu novo mecanismo de ação alostérico (MoA) visando a causa raiz da doença relacionada ao RYR-1 (RYR1-RM): mutação do Receptor 1 de Ryanodina (RYR1).
O gene RYR1 que codifica o Receptor 1 de Ryanodina RYR1, um canal intracelular de liberação de cálcio, vaza em doenças musculares. Vazamentos intracelulares de cálcio causados por canais RYR1 com mutação prejudicam a contração muscular, levando à fraqueza muscular e perda de função, e ativam vias tóxicas que danificam os músculos, causando os sintomas das doenças relacionadas ao RYR1.
O ensaio de Fase 1b, aberto, de escalonamento de dose confirmou a segurança, tolerabilidade e farmacocinética da dosagem de 120 e 200 mg de ARM210 diariamente durante 29 dias em homens e mulheres adultos afetados pelas doenças relacionadas ao RYR1 (RYR1-RM).
É importante ressaltar que o estudo também demonstrou eficácia preliminar no grupo de dose mais alta em dois sintomas característicos das doenças relacionadas ao RYR1 (RYR1-RM): 1) alívio significativo da fadiga avaliada pelo sistema PROMIS-fatigue (Patient-Reported-Outcome Measurement Information System) t-scores, e 2) melhora da força dos proximais avaliada pelo exame físico de abdução do ombro (Medical Research Council Grading). Estes resultados justificam o desenvolvimento futuro do ARM210 como um potencial tratamento e modificador da doença para as miopatias relacionadas ao RYR1 (RYR1-RM) em um ensaio de Fase 2 randomizado e controlado por placebo.
O ensaio de Fase 1b concluído foi conduzido em colaboração com o National Institute of Neurological Disorders and Stroke (NINDS) e National Institute of Health (NIH) sob um Acordo Cooperativo de Pesquisa e Desenvolvimento (CRADA - Cooperative Research and Development Agreement ), com o apoio da Fundação RYR-1, Pittsburgh, PA, EUA.

(Foto esquerda para direita: Dr. Tokunbor Lawal (autor da publicação), Dr. Mike Goldberg (co-fundador/Co-presidente de Pesquisas da Fundação RYR-1), e Dr. Payam Mohassel (Pesquisador Principal e Autor Senior)).
“Estamos muito satisfeitos com os resultados do ensaio com as doenças relacionadas ao RYR1 (RYR1-RM) conduzido em conjunto com o NIH, pois o estudo confirmou a segurança e tolerabilidade do ARM210, mas o mais importante, demonstrou pela primeira vez que o nosso Rycal®, ARM210, pode reverter os sintomas desta doença muscular crônica e devastadora em um curto período de tratamento. Isso é muito promissor”, disse Gene Marcantonio, M.D., Ph.D., CEO da ARMGO Pharma. “Esperamos, portanto, continuar rapidamente no desenvolvimento do ARM210 para levar este primeiro e potencial tratamento aos pacientes com as doenças relacionadas ao RYR1, com o apoio da Fundação RYR-1 e da comunidade de pacientes.”
Michael F. Goldberg, MD, MPH, co-presidente de pesquisa da Fundação RYR-1 acrescentou: “Estamos entusiasmados com a publicação deste importante estudo, pois representa um farol de esperança para muitos indivíduos e famílias de todo o mundo afetados pelas doenças relacionadas ao RYR1. Estamos ansiosos pelas próximas etapas de ensaios no desenvolvimento dessa importante droga.”
Mais informações sobre este estudo de Fase 1b podem ser encontradas online em: https://clinicaltrials.gov/study/NCT04141670. O ensaio foi apoiado pelos Programas de Pesquisa Intramural do NIH/NINDS, NIH/NINR, um NIH Clinical Center Bench to Bedside Award (2017-551673) e pelo parceiro de colaboração anterior da ARMGO, Les Laboratoires Servier. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente a opinião oficial dos Institutos Nacionais de Saúde.
BREVE REVISÃO SOBRE A FUNÇÃO DO RYR1 E DOENÇAS RELACIONADAS
Os RYRs são canais homotetraméricos de liberação de cálcio intracelular responsáveis pelo fluxo de Ca2+ dos retículos sarcoplasmáticos/endoplasmáticos (RS/RE) para o citoplasma da maioria dos tipos de células. RYR1 é a isoforma predominante no músculo esquelético de mamíferos, onde a liberação de Ca2+ via RYR1 é necessária para o acoplamento excitação-contração e função muscular normal. Já o RYR2 é a isoforma predominante no músculo cardíaco onde a liberação de Ca2+ via RYR2 é necessária para a função normal do músculo cardíaco. Mutações genéticas humanas nos genes RYR1 e RYR2 fazem com que o cálcio vaze dos canais RYR, levando à doença (Figura 1).
Os canais RYR normalmente alternam entre um estado de repouso (fechado) e excitado (aberto). Em certas doenças, em que existe a mutação genética, o RYR é modificado e torna-se incontinente ou seja, fica vazando. No caso do RYR1, este desempenha um papel crítico no músculo esquelético, e as mutações do RYR1 em humanos levam a uma miopatia progressiva, conhecida como doenças relacionadas ao RYR1 (RYR1-RM), privando o músculo da capacidade de responder eficazmente aos sinais de contração, levando à fraqueza muscular.
Sobre o Rycals® - A inibição do canal interromperia o vazamento, mas esta intervenção geralmente não seria benéfica, uma vez que bloquearia a função normal do RYR. O Rycals®, são moléculas que podem restaurar a função normal do canal sem bloquear o RYR, e abrem a possibilidade de intervenções terapêuticas.
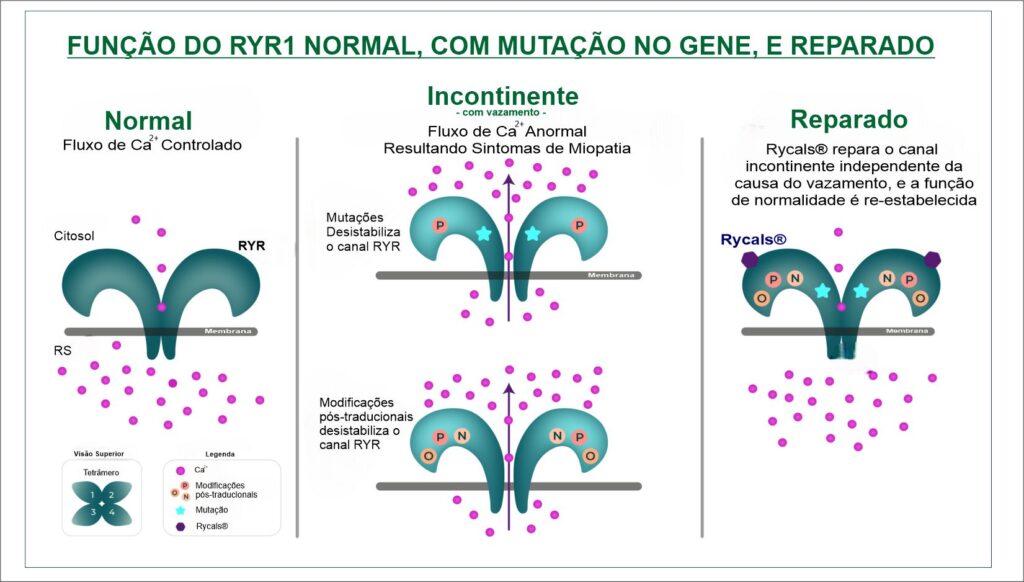
Figura 1: Modelo da função do RYR. O RYR controla o fluxo de cálcio (Ca2+) de dentro do retículo sarcoplasmático (RS) através da membrana até o citoplasma. (Quadro Esquerdo) O RYR normal regula o fluxo de cálcio alternando entre um estado fechado e aberto. (Quadro Meio) Na RYR1-RM, o RYR mutado apresenta vazamento, levando ao fluxo anormal de cálcio, resultando em sintomas da doença. Modificações pós-traducionais* (MPTs) do RYR agravam ainda mais o vazamento. Em outros distúrbios musculares, como DMD, insuficiência cardíaca ou sarcopenia, as modificações pós-traducionais (MPTs) do RYR podem causar vazamento no canal, levando a um fluxo anormal de cálcio, resultando em sintomas da doença. (Quadro Direito) Rycals® liga-se aos canais incontinentes (com vazamento) e repara o vazamento independentemente da causa do vazamento, restaurando a função normal do canal. O Rycals® não bloqueia o RYR.
*As modificações pós-traducionais (MPTs) são modificações químicas e estruturais de uma cadeia proteica após a sua tradução. Estas modificações podem determinar a atividade, a localização e interações com outras proteínas.
A Miopatia Congênita Centronuclear (MCCN) é uma doença muscular congênita rara caracterizada por fibras celulares com núcleos centralizados proeminentes em biópsias musculares. A doença é clinicamente heterogênea, variando de fenótipos hipotônicos graves já no nascimento até fraqueza muscular leve com início na idade adulta, e pode ter múltiplos modos de herança em associação de causa por mutações nos genes MTM1, DNM2, BIN1 e RYR1.
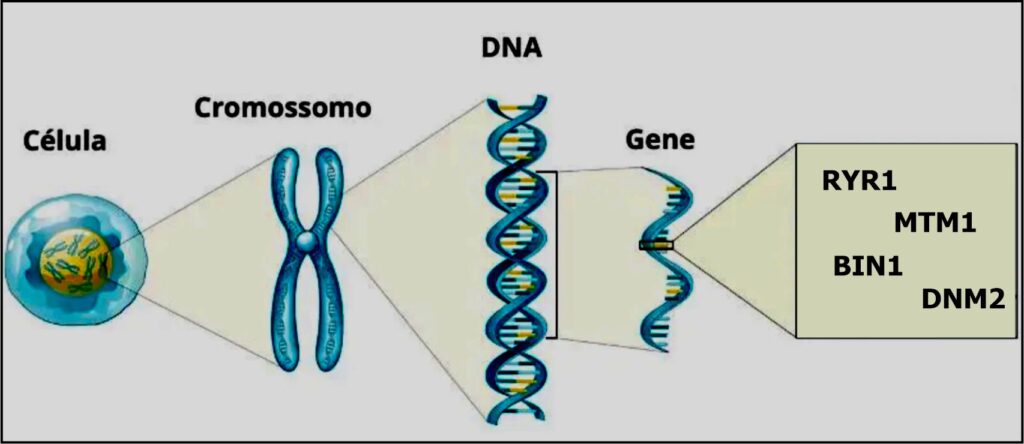
Assim como existe uma grande complexidade no diagnóstico de uma miopatia, tema esse abordado em outra postagem no SORRYR-1.com.br, essas diferentes causas, são também motivo de grande confusão em diagnósticos. É importante consultar um médico especialista para um diagnóstico preciso e assim obter informações detalhadas sobre a mutação específica no caso individual. As diferentes mutações genéticas que causam a Miopatia Congênita Centronuclear podem resultar em variações na gravidade, evolução e sintomas da doença. É importante dizer que a gravidade dos sintomas da doença pode variar de pessoa para pessoa, mesmo com a mesma mutação genética.
Seguem as diferentes causas de origem da Miopatia Congênita Centronuclear (MCCN):
O gene MTM1 é responsável pela codificação de proteína chamada miotubularina. Essa proteína desempenha um papel importante na função muscular, fundamental por atuar como uma enzima fosfatase de desempenho crítico na regulação do tráfego de vesículas dentro das células musculares, particularmente nas fibras musculares esqueléticas. Quando há uma mutação no gene MTM1, a produção ou função da miotubularina é afetada, e sso pode resultar em um acúmulo anormal de vesículas dentro das fibras musculares, levando à fraqueza muscular e outros sintomas associados à Miopatia Congênita Centronuclear.
A dinamina 2, codificada pelo gene DNM2, desempenha um papel crucial na regulação do tráfego de vesículas que transportam proteínas essenciais para a função muscular normal. Ela ajuda a controlar a fusão e divisão dessas vesículas, permitindo a entrega adequada de proteínas contráteis, como a miosina e actina, aos locais onde são necessárias para a contração muscular.
Quando ocorrem mutações no gene DNM2, a função da dinamina 2 pode ser comprometida, resultando em distúrbios que pode levar a fraqueza muscular, em especial nos músculos proximais, e outros sintomas associados a condições da MCCN. Portanto, a dinamina 2 desempenha um papel importante na manutenção da função muscular saudável.
O gene BIN1 codifica a proteína anexina A2, que está envolvida na regulação das membranas celulares e no tráfego de vesículas nas células musculares. Essas funções desempenhadas pela anexina A2 são essenciais para a saúde e a função das fibras musculares, a mutação nesse gene afeta negativamente a estrutura e a função das células musculares, o que resulta em fraqueza muscular e outros sintomas associados à CCNM. A gravidade e a apresentação dos sintomas podem variar com base na mutação específica do gene BIN1 envolvida.
O gene RYR1 codifica o receptor de rianodina 1, que é uma proteína essencial para a função das fibras musculares. O receptor de rianodina está envolvido na liberação (válvula de controle) de cálcio das reservas intracelulares, um processo fundamental para a contração e relaxamento muscular.
As doenças musculares são aquelas que afetam a estrutura e funcionamento do músculo, sendo as principais: as distrofias musculares, as miopatias congênitas, as miopatias inflamatórias e as miopatias endócrinas e metabólicas. É importante destacar que cada uma delas possui suas variações que também se diferenciam.
Essas doenças já foram muito confundidas em diagnósticos no passado, e fico triste, porque isso ainda tem acontecido nos dias de hoje, mesmo com os avanços científicos. A única razão que acredito ser ainda a causa para essa confusão nesses diagnósticos seria por essas doenças serem consideradas “doenças raras”, portanto, muitas vezes desconhecidas por parte da comunidade médica. Assim, pode haver a falha no momento dos exames clínicos, ponto inicial para diagnóstico de qualquer doença.
Eu mesmo vivi uma experiência dessa, pois no decorrer de grande parte da minha vida eu recebi vários “diagnósticos” de Distrofia Muscular Congênita (DMC) do tipo: Duchenne, Facioescapuloumeral e Cinturas. E, os prognósticos foram do pior a até o mais brando. Estes diagnósticos ou hipóteses de diagnósticos vieram até de importantes instituições, como de uma clínica indicada pelo MDA (Muscular Distrophy Association), maior referência ligada a essa doença.
Deve-se levar em consideração que, naquela época, pouco se sabia sobre essa doença, nem tão pouco sobre a genética humana; contudo, um erro de diagnóstico hoje em dia seria inaceitável. Essa situação causou em mim grandes transtornos, de emocional aos físicos. Somente aos 44 anos de idade foi que finalmente obtive meu correto e “definitivo diagnóstico”, ou seja, de que sou portador de Miopatia Congênita Centronuclear (MCC), causada pela mutação no gene RYR1.
A Distrofia Muscular Congênita e a Miopatia Congênita Centronuclear apresentam várias características em comum, tais como: são doenças de origem genética, afetam os músculos esqueléticos, caracterizam-se clinicamente por hipotonia e fraqueza muscular, geralmente apresentam-se desde o nascimento, têm curso clínico estático ou lentamente progressivo. Essas doenças não tem cura, e o tratamento envolve terapia de suporte, como fisioterapia, dispositivos de mobilidade e, em alguns casos, medicamentos. Mesmo assim, as duas doenças neuromusculares diferem entre si.
Daí, eu volto com a questão sobre as falhas nos diagnósticos, já que muitos médicos se prendem somente ao resultado do exame genético e não conhecerem os sinais clínicos das diferentes doenças e particularidades dos indivíduos afetados.
Assim, essas noções devem ser levadas em consideração por três razões: Primeiro, muitas das miopatias congênitas podem ser causadas por mutações em mais de um gene, o que sugere um impacto da heterogeneidade genética. Segundo, mutações no mesmo gene podem causar diferentes patologias musculares. Terceiro, a mesma mutação genética pode levar a diferentes características patológicas e sintomatológicas em membros da mesma família ou no mesmo indivíduo em idades diferentes.
Em resumo, eu destacaria que tanto a Distrofia Muscular, quanto a Miopatia Congênita Centronuclear são de origem genética, mas distintas em termos de suas características clínicas e podem variar em gravidade de pessoa para pessoa. Enquanto a Distrofia Muscular envolve a degeneração progressiva dos músculos devido a problemas na estrutura das proteínas musculares, a Miopatia Congênita Centronuclear é caracterizada por uma anormalidade na localização dos núcleos das células musculares. Assim, é importante consultar um médico especialista para um diagnóstico preciso, para que se possa ser feito um acompanhamento adequado do caso, pois o tratamento pode variar dependendo da condição clínica específica de cada indivíduo.