O entendimento das pessoas evolui à medida que a ciência avança, e novas descobertas são feitas. Nesta dinâmica, o avanço médico e científico ao longo dos últimos anos teve um impacto significativo no diagnóstico e na percepção médica sobre as doenças.
Com o desenvolvimento de novas tecnologias, métodos de pesquisa e compreensão biológica, o conhecimento genético avançou de maneira notável, especialmente após se ter conseguido fazer o o mapeamento do genoma humano. Agora, através do resultado genético é possível não só diagnosticar uma doença, mas entender seu impacto no indivíduo, e adaptar as abordagens com base no perfil genético de cada paciente.
Nestes meus mais de 60 anos, senti na pele essa grande reviravolta na ciência, no que diz respeito ao conhecimento médico e diagnóstico da minha doença. Vivi até meus 44 anos, com vários diagnósticos errados, abordagens diferentes, até que tive finalmente o diagnóstico sobre a doença que me afeta, a Miopatia Congênita Centronuclear (MCC). Essa doença é causada pela mutação no gene RYR1, não tem cura, nem tratamento. Apesar da dureza sobre as informações sobre a doença, ter o diagnóstico de certa forma me trouxe uma “espécie de alívio“. O RYR1 é responsável pelo controle do fluxo de íons de cálcio para dentro da célula muscular, que faz o músculo contrair e relaxar.
Naquela época, o resultado histológico, feito por uma biópsia muscular, era tido como sendo uma informação importante no diagnóstico, e acompanhamento clínico, porque através dele podia-se saber e diferenciar se o indivíduo era afetado por exemplo, por Miopatia Congênita Centronuclear (MCN), Miopatia Central Core (MCC), Doença Multi-Minicore (DMm), ou Desproporção Congênita do Tipo de Fibra (DCTF). Aconteceu que através de minha vivencia em meio ao pequeno mundo dos afetados por essa doença, pude ver diferentes pessoas afetadas por MCN com a evolução diferente, assim como comparados com indivíduos em pior condições físicas em relação a um outro com MCC, ou DCTF, da mesma verificando também no inverso.
O avanço das técnicas de diagnóstico genético, nos trouxe uma mudança significativa, permitindo identificar diretamente variantes no gene RYR1, possibilitando uma visão mais precisa e específica da doença. Essa abordagem é preferível porque pode confirmar a presença de alterações no gene, mesmo na ausência de características histopatológicas distintivas, permitindo uma melhor orientação do prognóstico e o acompanhamento clínico do paciente.
Passado um tempo, descobri que no diagnóstico da doença, a histologia não tem um papel tão relevante quanto anteriormente, mas sim a herança e variação genética, em que é separado as formas recessivas e dominantes. Clinicamente observa-se evolução clínica com quadros mais graves em indivíduos com herança recessiva.
Em recente conversa com Michael F. Goldberg, MD, MPH, Presidente do Conselho, Co-Presidente de Pesquisa e Co-Fundador da @theryr1foundation, ele me disse: “Casos recessivos de RYR-1 tendem a ser mais graves quando associados a variantes do gene RYR1 resultando em expressão reduzida da proteína receptora RYR-1. As formas dominantes tendem a ser menos graves porque essas variantes geralmente não resultam em quantidades reduzidas da proteína receptora RYR-1. Os diagnósticos histopatológicos derivados da biópsia muscular (por exemplo, Centronuclear, Central Core, ou DCTF, etc.) não parecem ser muito informativos e não são específicos para fenótipos específicos mesmo para RYR1. Portanto, houve um afastamento do diagnóstico histopatológico e uma ênfase maior no diagnóstico genético .”
Em resumo, os diagnósticos histopatológicos obtidos a partir de biópsias musculares, como Centronuclear, Central Core, Desproporção Congênita do Tipo de Fibra, ou Multi Mini Core, não são muito informativos, e não são específicos para certos fenótipos. Isso levou a uma mudança para um maior enfoque no diagnóstico genético, que é mais preciso e informativo. Esse avanço no entendimento científico, permitiu a identificação e conhecimento das variantes genéticas, e sua relação com a gravidade das doenças associadas ao gene RYR1, crucial para um diagnóstico eficaz, e para o desenvolvimento de abordagens adequadas ao paciente.
As doenças relacionadas ao RYR1 são identificadas com base em sua classificação histopatológica, isto é, pela aparência da biópsia do músculo na lâmina do microscópio. A diferenciação encontrada na biópsia designará o tipo da doença, se é por exemplo, Miopatia Central Core, Miopatia Multiminicore, Miopatia Centronuclear, ou Desproporção Congênita de Tipos de Fibras.
A Miopatia Congênita Centronuclear (MCCN) e a Miopatia Central Core (MCC) são ambas doenças musculares hereditárias causadas por mutações genéticas. A MCCN pode estar associada a mutações em diferentes genes, no DNM2, BIN1, MTM1, e RYR1, já a MCC está associada somente ao gene RYR1.
Esses tipos de doenças relacionadas ao RYR1 variam amplamente em termos dos seus diferentes sinais e sintomas, de quando eles inicialmente se apresentaram, além da sua respectiva gravidade. Embora sejam altamente variáveis, os sintomas presentes também dependem se a mutação do gene RYR1 é autossômica dominante ou autossômica recessiva.
Uma pergunta que sempre chega até mim é sobre as diferenças entre a Miopatia Centronuclear e a Miopatia Central Core. Assim, eu, enquanto portador da Miopatia Congênita Centronuclear (MCN), buscarei esclarecer pontualmente neste texto, me atendo ao tipo que me acomete, que é a pela mutação no gene RYR1.
Estas doenças apesar de terem sintomas parecidos e compartilharem de algumas características clínicas em comum, se confundem entre si, e apresentam com algumas diferenças distintas:
Miopatia Congênita Centronuclear (MCCN)
Miopatia Central Core (MCC)
Em resumo, a Miopatia Congênita Centronuclear e a Miopatia Central Core, ambas doenças relacionada ao RYR1, têm seus sintomas e sinais físicos que podem se parecer, podem se confundir, mas são diferentes, a contar da análise histológica das células musculares em uma biópsia, exame este que é crucial para diferenciar entre as duas condições e determinar o diagnóstico correto, conduta médica, tratamento, e até prognóstico de evolução.
Nota: todo o material escrito nesta página é oriundo de pesquisa científica, e conclusões próprias do autor deste website, que convive como portador, desde o nascimento, com a Miopatia Congênita Centronuclear causada pela mutação no gene RYR-1
Me chamo Lise, e sou mãe de um menino de 10 anos, João Miguel, diagnosticado com a Mutação do Gene Ryrr.1 Central Core. Moramos na cidade de Criciúma no Estado de Santa Catarina, Brasil. Eu e meu esposo esperamos o João por sete anos, e seu nascimento trouxe alegria a nossa casa.

O João nasceu com um pezinho torto congênito, e nos seus primeiros dias de vida passou a usar gesso até os 11 meses de idade, como também foram feitas duas cirurgias para concluir a correção do pé. O João começou a engatinhar com um ano e três meses e caminhar com um ano e nove meses, achávamos que esse atraso motor era pelo tempo que ele passou em recuperação do pezinho.
Aos três anos percebemos as quedas constantes e levamos esta nossa preocupação ao ortopedista que o acompanhava desde bebê. Após analise clinica o Dr percebeu a fraqueza muscular e que o João realizava a manobra de Gowers ao levantar-se. Saímos do consultório com encaminhamento para o Neurologista e ali iniciava-se anos de buscas e angustias por um diagnóstico. Foi realizado a eletromiografia onde constatou-se a fraqueza muscular, e vários exames. Mesmo o CPK com resultado normal, os médicos procuravam as doenças degenerativas mais graves, como Duchenne e Becker.
Aos cinco anos foi feito o exame do Painel Genético para as setenta doenças degenerativas musculares e veio o resultado negativo para todas elas. Foi um misto de alegria e angustia, pois não tínhamos fechado o diagnóstico. Aos três anos iniciamos os tratamentos recomendado pelo médico, com fisioterapias, equoterapia e natação. O desenvolvimento após inicio do tratamento foram visíveis, o João passou a ter mais equilíbrio, as quedas diminuíram, começou a subir escadas com apoio e ter mais firmeza para desce-las, a cada dia percebemos o progresso (lento), mais sempre constante na sua condição física.
Este ano (2023), após 7 anos de busca, conseguimos fechar o diagnóstico do João com o Exoma. Com o diagnostico a fisioterapeuta que o acompanha desde o inicio da nossa jornada montou um novo cronograma de exercícios, e adotamos que a “Vida é Movimento” então vamos nos movimentar e continuar escrevendo uma história linda para nosso menino que é cheio de vida e alegria!
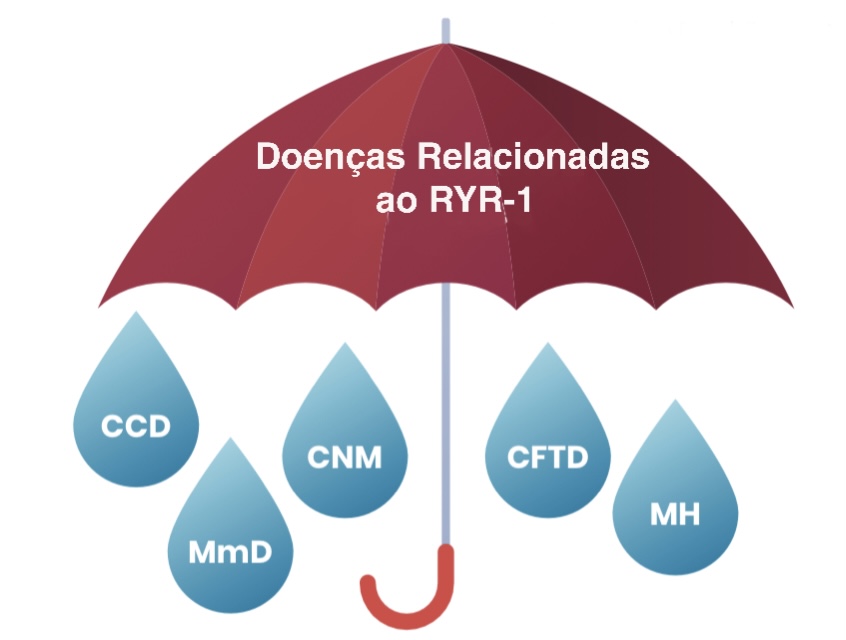
DOENÇAS RELACIONADAS AO RYR-1 É UM TERMO “GUARDA-CHUVA”, OU SEJA, QUE ABRANGE ALGUMAS DIFERENTES DOENÇAS MUSCULARES
As doenças relacionadas ao RYR1 são raras, e classificadas como doenças órfãs , “órfãs”, se trata de um termo usado para identificar uma doença que afeta uma pequena percentagem da população. A verdadeira prevalência dessas doenças é difícil de calcular, pois muitos casos são mal diagnosticados ou não diagnosticados. Também há relatos de prevalência ligeiramente aumentada em certas populações étnicas e geográficas.
As doenças relacionadas ao RYR1 são devidas a uma mutação ou mutações no gene RYR-1. Na prática, podemos sintetizar o processo de mutação da seguinte maneira: o gene RYR-1 codifica o receptor RYR-1, o qual é um canal de cálcio no retículo sarcoplasmático do músculo esquelético; o fluxo de cálcio através do receptor RYR-1 é um componente crítico para a excitação-contração muscular. Uma mutação no gene RYR-1 pode alterar o número, estrutura e/ou função do receptor RYR-1, podendo assim desencadear uma ampla gama de sintomas, e consequências clínicas diferentes, que podemos chamar de doenças relacionadas ao RYR1.
As doenças relacionadas a RYR-1 (RYR1-RD) receberam, seus nomes com base na classificação histopatológica, ou seja, pela forma que músculo apareceu na biópsia sob um microscópio (por exemplo, Miopatia Central Core, Doença Multi-Minicore, Miopatia Centronuclear, e Desproporção Congênit26a do Tipo de Fibra). Além disso, muitos casos de Hipertermia Maligna (HM) ocorrem devido a uma mutação no gene RYR1. Esses vários termos têm sido uma fonte de confusão para pacientes e médicos. É fundamental lembrar que, independentemente da aparência microscópica da biópsia muscular, são necessários testes genéticos para confirmar o diagnóstico de doenças relacionadas ao RYR-1.
Doenças Relacionadas a RYR-1 (RYR-1-RD) é um termo “guarda-chuva” que abrange doenças musculares que ocorrem como resultado de mutações no gene RYR1. Estes incluem condições que historicamente receberam seus nomes com base na classificação histopatológica, ou seja, como a biópsia muscular apareceu sob um microscópio (por exemplo, doença do núcleo central, doença de múltiplos minicores, miopatia centronuclear e desproporção do tipo de fibra congênita. hipertermia maligna (HM) é devido a uma mutação no gene RYR1.
Miopatia Central Core - Central Core Disease (CCD)
Verifique os tipos de Doenças Relacionadas ao RYR1 a seguir...
Miopatia Central Core - Central Core Disease (CCD)
Miopatia Central Core (CCD) é o termo usado pelos patologistas para descrever o tecido de biópsia muscular desprovido de uma mancha específica no meio de uma fibra muscular, dando a aparência de "núcleo". A CCD causa uma fraqueza muscular que varia de quase assintomática a muito grave. A maioria das pessoas com CCD experimentam fraqueza muscular leve e persistente que pode piorar com o tempo. Essa fraqueza afeta os músculos próximos ao centro do corpo (músculos proximais), particularmente os músculos das coxas e quadris. A fraqueza muscular também pode fazer com que os bebês afetados pareçam "moles" e pode atrasar o desenvolvimento de suas habilidades motoras, como sentar, levantar e andar. Em casos graves, os bebês afetados apresentam tônus muscular profundamente fraco (hipotonia), resultando em dificuldades de alimentação e problemas respiratórios graves ou com risco de vida. O CCD também está associado a anormalidades esqueléticas, como curvatura anormal da coluna vertebral (escoliose), luxação do quadril e deformidades articulares chamadas contraturas que restringem o movimento de certas articulações. Indivíduos com CCD tendem a permanecer ambulatoriais durante toda a vida.
Doença Multi-Minicore (MmD)
A Doença Multi-minicore (MmD) é uma doença que clinicamente causa fraqueza muscular e problemas de saúde relacionados, que variam de leves a fatais. Os pesquisadores identificaram pelo menos quatro formas de MmD, que podem ser distinguidas por seus sinais e sintomas característicos. A forma mais comum, chamada de forma clássica, causa fraqueza muscular começando na primeira infância. Essa fraqueza é mais perceptível nos músculos do tronco e pescoço (músculos axiais), e é menos grave nos músculos dos braços e pernas. A fraqueza muscular faz com que os bebês afetados pareçam "moles" (hipotônicos) e podem atrasar o desenvolvimento de habilidades motoras, como sentar, ficar em pé e andar. A doença faz com que os músculos da parede torácica e da coluna endureçam. Quando combinada com a fraqueza dos músculos necessários para respirar, essa rigidez leva a problemas respiratórios graves ou com risco de vida. Quase todas as crianças com MmD desenvolvem uma curvatura anormal da coluna vertebral (escoliose), que aparece durante a infância e piora constantemente ao longo do tempo. Deve-se notar que certos indivíduos com MmD têm mutações no gene RYR-1, enquanto outros indivíduos têm mutações em outros genes (por exemplo, SEPN1).
Miopatia Congênita Centronuclear - Centronuclear Myopathy (CNM)
A Miopatia Congênita Centronuclear (CNM), tem sido associada a várias condições genéticas diferentes, incluindo mutações no RYR-1. Indivíduos com CNM geralmente começam a sentir fraqueza muscular a qualquer momento, desde o nascimento até o início da idade adulta. Muitos dos sintomas da CNM coincidem com os da Central Core (CCD). A fraqueza muscular causada pela CNM pode levar ao atraso no desenvolvimento de habilidades motoras (engatinhar ou andar) e pode ser lentamente progressiva. Algumas pessoas afetadas podem precisar de assistência em cadeira de rodas. Outros sintomas incluem: problemas respiratórios leves a graves, ptose (queda da pálpebra superior), fraqueza nos músculos faciais, anormalidades nos pés, um arco alto no céu da boca (palato arqueado) e escoliose.
Desproporção Congênita do Tipo de Fibra - Congenital Fiber - Type Disproportion (CFTD)
Indivíduos com a doença da Desproporção Congênita do Tipo de Fibra (CFTD), geralmente experimentam fraqueza muscular, principalmente nos músculos dos ombros, braços, quadris e coxas. A fraqueza também pode afetar os músculos da face, músculos que controlam os movimentos oculares (oftalmoplegia) e músculos da pálpebra superior (ptose). Os indivíduos com CFTD geralmente têm uma face longa, um arco alto no céu da boca (palato arqueado alto) e dentes apinhados. Os indivíduos afetados podem ter deformidades articulares (contraturas) e uma região lombar anormalmente curvada (lordose) ou uma coluna que se curva para o lado (escoliose). Aproximadamente 30% das pessoas com esse distúrbio apresentam problemas respiratórios leves a graves relacionados à fraqueza dos músculos necessários para respirar. Algumas pessoas que experimentam esses problemas respiratórios precisam do uso de uma máquina para ajudar a regular a respiração à noite e, ocasionalmente, durante o dia. Cerca de 30% dos indivíduos afetados têm dificuldade em engolir devido à fraqueza muscular na garganta. Raramente, as pessoas com essa condição têm um músculo cardíaco enfraquecido e aumentado (cardiomiopatia dilatada).
Suscetibilidade a Hipertermia Maligna - Malignant Hyperthermia Susceptibility (MH)
Indivíduos sensíveis à Hipertermia Maligna (MH) podem experimentar uma vida diária normal sem qualquer sintoma ou fraqueza muscular. No entanto, quando expostos a certos agentes anestésicos, os pacientes podem experimentar um episódio de Hipertermia Maligna. A Hipertermia Maligna caracteriza-se por um estado hipermetabólico, causando um aumento anormal do calor, com rigidez excessiva e quebra muscular associada, e aumento da frequência cardíaca. As complicações graves da HM incluem: lesão cerebral, sangramento interno, parada cardíaca e/ou falência de múltiplos órgãos. As complicações cardiovasculares associadas podem ser fatais. Qualquer indivíduo com uma mutação(ões) do RYR-1, se a anestesia for necessária para um procedimento médico-cirúrgico, é aconselhado a tomar "precauções contra hipertermia maligna". Indivíduos com mutações RYR-1 suscetíveis a MH também correm risco de rabdomiólise, bem como outras dores e cãibras musculares relacionadas ao calor e ao esforço. Rabdomiólise é o termo geral para ruptura muscular associada a uma ampla variedade de gatilhos externos, incluindo: exercícios extenuantes além do limite de fadiga, abuso de drogas ou álcool, uso de suplementos ou certos medicamentos, doença viral recente ou trauma muscular. Os sinais e sintomas da rabdomiólise incluem dor muscular intensa, elevação repentina e queda subseqüente dos níveis séricos de creatina fosfoquinase (CPK) e produtos da quebra muscular na urina ("mioglobinúria"). O curso da rabdomiólise é caracterizado principalmente por mialgia (dor muscular) com aumentos leves a moderados da CPK. Nesses casos leves, muitos indivíduos não procuram atendimento médico. No entanto, em alguns o curso clínico é grave, resultando em hiper-CK-emia profunda, insuficiência renal aguda, síndrome do compartimento, coagulação intravascular disseminada, arritmias cardíacas secundárias a desequilíbrios eletrolíticos e, possivelmente, parada cardíaca se não tratada. Portanto, indivíduos com mutações no RYR-1, especialmente aquelas conhecidas por estarem associadas à suscetibilidade ao HM, devem estar cientes dos gatilhos da rabdomiólise e podem querer consultar um médico antes do início de um regime de exercícios e/ou esportes. Pode haver um papel do dantroleno como agente profilático na prevenção da rabdomiólise e de outros sintomas musculares relacionados ao esforço e ao calor.