Buscando estar sempre conectado com as notícias relacionadas e de interesse dos portadores de mutação no gene RYR1, mais especificamente a Miopatia Congênita Centronuclear, que se trata da doença que me acomete, tomei conhecimento da recente pré-publicação científica, intitulada, “O Propofol liga-se diretamente e inibe o receptor 1 de rianodina do músculo esquelético (RYR1)”, versão postada em 12 de janeiro de 2024, na qual os pesquisadores, Thomas T. Joseph, MD, PhD¹, Weiming Bu, PhD¹, Omid Haji-Ghassemi, PhD², Yu Seby Chen, PhD², Kellie Woll, PhD², Paul D. Allen, MD, PhD⁴, Grace Brannigan, PhD³, Filip Van Petegem, PhD², Roderic G. Eckenhoff, MD¹, através de resultados obtidos em estudos e ensaios sugerem em seus relatos que o propofol, um agente anestésico intravenoso de curta ação, em concentrações clínicas, se liga ao receptor de rianodina tipo 1 (RYR1), inibindo sua abertura, podendo assim, prevenir as manifestações clínicas da Hipertermia Maligna (HM), mesmo com exposição a agentes desencadeantes como os anestésicos voláteis.
Confira a integra da publicação pelo seguinte link: https://www.biorxiv.org/content/10.1101/2024.01.10.575040v1.full
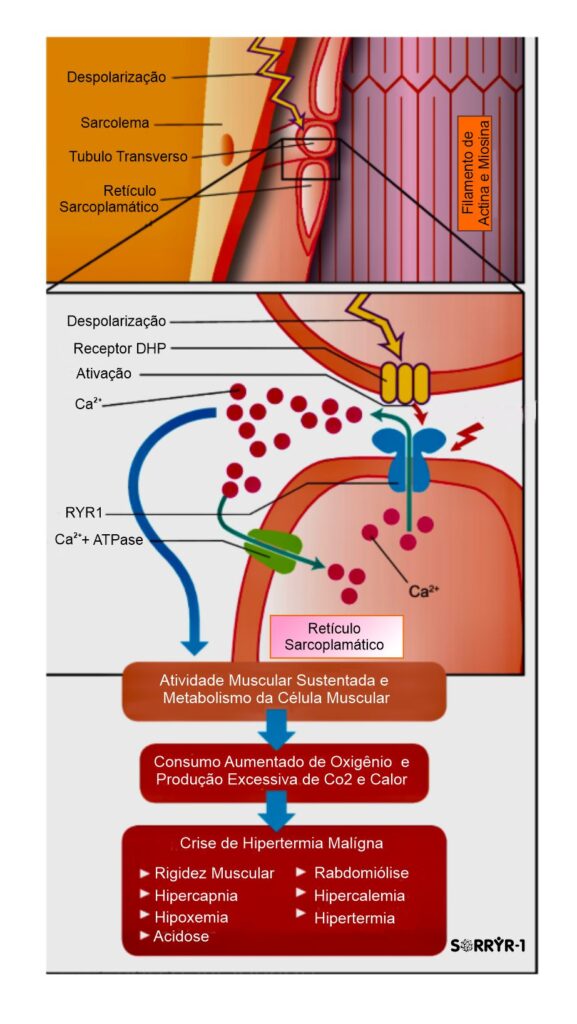
O receptor de rianodina tipo 1 (RYR1) desempenha um papel central na determinação de quando (tempo), e quanta (quantidade) força é produzida pelos músculos esqueléticos, que é necessária e essencial para movimentação do corpo e atividades físicas diárias dos indivíduos. Como principal canal de liberação de íon de cálcio (Ca²⁺) no retículo sarcoplasmático do músculo esquelético, a mutação genética no receptor de rianodina tipo 1 (RYR1), tem a ela subjacentes, algumas doenças ou distúrbios musculares, tais como a Miopatia Centronuclear, Miopatia Central Core, Miopatia Multi-Minicore, Desproporção Congênita do Tipo de Fibra, incluindo distúrbios como a Rabdomiólise por Esforço, e a Hipertermia Maligna (HM).
Em pacientes com a mutação no gene RYR1, “a crise” de Hipertermia Maligna, causada pela exposição a algumas drogas desencadeantes, como os anestésicos voláteis halogenados, pode direcionar o RYR1 a deixar o canal de rianodina em um estado aberto, resultando em uma liberação descontrolada de Ca²⁺, acarretando em tensão no sarcômero, e consequente produção de calor. A restauração de Ca²⁺ no retículo sarcoplasmático também consome ATP (adenosina trifosfato), molécula responsável pelo depósito de energia celular, gerando também por consequência uma carga metabólica adicional insustentável.
Ao anestesiar pacientes com mutações genéticas conhecidas pela suscetibilidade a Hipertermia Maligna, o anestésico geral intravenoso não desencadeante propofol é comumente substituído por anestésicos desencadeantes. As evidências de ligação direta de agentes anestésicos ao RYR1 ou seus parceiros de ligação são escassas, e as interações em nível atômico do propofol com o RYR1 são totalmente desconhecidas. Os pesquisadores mostram no trabalho acima descrito que o propofol diminui a abertura do receptor do canal de rianodina (RYR1) com vesículas no retículo sarcoplasmático e bicamadas lipídicas planas, e que inibe a liberação de Ca²⁺ induzida por ativador do retículo sarcoplasmático no músculo esquelético humano. Além de confirmar a ligação direta, a marcação por fotoafinidade usando m-azipropofol (AziPm) revelou vários supostos locais de ligação de propofol no RYR1. A projeção pela simulação dinâmica da afinidade de ligação molecular sugere que o propofol se liga a pelo menos um destes locais em concentrações clínicas. Esses achados convidam à hipótese de que, além de o propofol não desencadear a Hipertermia Maligna, ele também pode ser protetor contra a Hipertermia Maligna, inibindo o fluxo induzido de Ca²⁺ através do canal de rianodina - RYR1.
¹ Department of Anesthesiology and Critical Care, Perelman School of Medicine, University of Pennsylvania, Philadelphia, PA USA; ² Department of Biochemistry, University of British Columbia, Vancouver, BC, Canada; ³ Department of Physics and Center for Computational and Integrative Biology, Rutgers University, Camden, NJ USA; ⁴ Department of Anesthesiology, University of Tennesee, Knoxville, TN USA
O artigo acima mencionado foi publicado na bioRxiv, repositório aberto de pré-publicação direcionado as ciências biológicas (https://www.biorxiv.org/), e hospedado pelo Cold Spring Harbor Laboratory (CSHL).
Recentemente me submeti a uma colonoscopia e endoscopia no Hospital Israelita Albert Einstein, um exame de rotina, mas dado a minha questão com a suscetibilidade a Hipertermia Maligna, os procedimentos foram feitos cercados por forte critérios de segurança, contudo, infelizmente dado ao pouco conhecimento sobre essa doença, esse protocolo de seguranaça é observado em poucas instituições hospitalar.
A Hipertermia Maligna (HM) é uma condição rara e séria, a qual pode ser desencadeada pela administração de certos anestésicos. Os indivíduos com mutação no gene RYR1 têm a 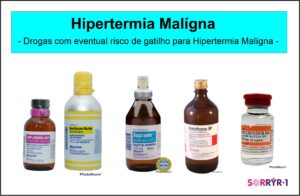 suscetibilidade em ter o episódio de HM. O episódio de HM se não atendido no momento certo, com as drogas e procedimentos corretos pode ser fatal. É muito importante destacar que atualmente já existem identificados anestésicos que devem ser evitados, contudo, por ser uma doença pouco conhecida, além de se evitar essas drogas, os cuidados em qualquer procedimento médico envolvendo anestesia, deve ter uma atenção dobrada. A aplicação de anestesia não se restringe a procedimentos cirúrgicos, mas também em entubação, pequenas intervenções em pronto-socorro, dentre outros.
suscetibilidade em ter o episódio de HM. O episódio de HM se não atendido no momento certo, com as drogas e procedimentos corretos pode ser fatal. É muito importante destacar que atualmente já existem identificados anestésicos que devem ser evitados, contudo, por ser uma doença pouco conhecida, além de se evitar essas drogas, os cuidados em qualquer procedimento médico envolvendo anestesia, deve ter uma atenção dobrada. A aplicação de anestesia não se restringe a procedimentos cirúrgicos, mas também em entubação, pequenas intervenções em pronto-socorro, dentre outros.
Diante do exposto, se alguém tem suscetibilidade à Hipertermia Maligna, é crucial comunicar isso à equipe médica antes da anestesia. Seguem alguns cuidados a serem considerados:
Dado à seriedade deste assunto, devo iniciar o texto com as palavras conclusivas sobre o tema… a HIPERTERMIA MALIGNA é uma doença grave, com risco de morte, que se apresenta em forma de crise, acionada por um gatilho, que é normalmente uma droga anestésica, sendo os portadores de mutação no gene RYR1, os indivíduos com maior risco de ser afetado, daí a afirmação, “HIPERTERMIA MALIGNA, PONTO DE ATENÇÃO PARA OS MÉDICOS ANESTESISTAS, PREOCUPAÇÃO PARA OS PORTADORES DE MUTAÇÃO DO GENE RYR1”. Os anestesistas devem ter o conhecimento sobre a doença e assumir que todas as pessoas com mutação no gene RYR1 correm risco de Hipertermia Maligna. No caso de qualquer procedimento médico que seja necessário anestesia, o portador de mutação de no gene RYR1 deve fazer com que o cirurgião e anestesista saiba sobre sua mutação no gene RYR1, portanto com Suscetibilidade a Hipertermia Maligna (MHS), assumindo assim os eventuais riscos, para tomar precauções e administrar um tipo seguro de anestésico. É recomendado também aos portadores da mutação do RYR1 que portem uma identificação de advertência médica indicando seu risco de HM, em caso de emergência, neste caso, um adesivo em todos os documentos pessoais (Ex.: Identidade, CNH, Passaporte, Carteira do Plano de Saúde, e etc).
CONCEITO
A Hipertermia Maligna (HM) é uma patologia de relação farmacogenética. E isso significa que a doença se manifesta através de um episódio/crise em indivíduos que tenham uma suscetibilidade genética, devido a uma mutação em um determinado gene, acontecendo caso sejam expostos a gatilhos anestésicos (fármacos = medicamentos). Essa predisposição é chamada de "Suscetibilidade à Hipertermia Maligna” (MHS). Genericamente, explica-se que a Hipertermia Maligna (HM) é uma reação biológica em que o corpo humano superaquece a ponto de um colapso muscular, e é considerada uma emergência médica. Se alguém com Hipertermia Maligna não for tratado a tempo, como consequência pode resultar em insuficiência renal, dano cerebral, parada cardíaca, falência de órgãos adicionais, e até morte.
Os indivíduos com Suscetibilidade à Hipertermia Maligna (MHS) podem também apresentar uma crise em resposta a outros gatilhos externos, como por exemplo, ao esforço físico, que poderá causar a Rabdomiólise (quebra muscular), e neste caso apresentando outros sintomas, tais como, cãibras severas, rigidez muscular, e intolerância ao calor.
A genética à Suscetibilidade à Hipertermia Maligna (MHS) é complexa, e vários genes têm sido identificados desempenhando um papel patogênico na Hipertermia Maligna, sendo o RYR1 o mais estudado. Este gene codifica o receptor 1 de Ryanodina (RyR-1), uma proteína do canal de cálcio do retículo sarcoplasmático, expressa predominante na célula muscular. Sabe-se que na maioria dos casos da Suscetibilidade à Hipertermia Maligna (MSH), ela apresenta um traço autossômico dominante, e isso significa que se você tem MHS, um de seus pais provavelmente também tem a MHS. Também significa que cada um de seus filhos têm 50% de chance de herdar a MHS. No entanto, a dita complexidade se prova quando os médicos também observaram a Hipertermia Maligna em pessoas com mutações RYR1 autossômicas recessivas.
Em alguns casos, ao contrário do que se pensa, a Suscetibilidade à Hipertermia Maligna (MHS) pode ocorrer na ausência de fraqueza muscular, em outras palavras, os indivíduos com MHS têm força normal ou até mesmo aumentada, e seu único “sintoma” é a suscetibilidade a reações de Hipertermia Maligna (HM). Por outro lado, a MHS também pode ocorrer em pacientes com Doenças Relacionadas ao RYR1 (RYR-1-RD) com sinais e sintomas típicos de miopatia (fraqueza muscular). Os gatilhos para Hipertermia Maligna incluem certos medicamentos usados para anestesia geral, ou seja, quando alguém é “colocado para dormir”, geralmente antes de uma cirurgia. A anestesia geral é usada em uma ampla variedade de ambientes, incluindo salas de cirurgia, salas de emergência e unidades de terapia intensiva (UTI). Medicamentos específicos conhecidos por desencadear a Hipertermia Maligna incluem anestésicos administrados por via intravenosa, e inalatória via tubo respiratório, como segue:

Mutações no RYR1 associadas a Hipertermia Maligna (HM) mostram uma penetrância variável, e isso significa que uma pessoa pode passar por várias exposições a gatilhos sem problemas antes que uma reação de HM ocorra pela primeira vez. Para tornar as coisas ainda mais confusas, as pessoas com a mesma mutação (incluindo membros da mesma família) podem ter reação clínica diferente, o que significa que algumas podem ser sensíveis ao calor, algumas podem ter reações de HM à anestesia, algumas podem ter rabdomiólise com exercícios físicos, e algumas podem não ter problemas com nenhuma dessas condições.
QUADRO CLÍNICO
O quadro clínico de um episódio/crise de Hipertermia Maligna é variável, e compreende manifestações de alterações metabólicas, de lesão muscular, e das complicações secundárias. Esta condição é expressa por rigidez muscular, aumento do consumo de oxigênio e produção de gás carbônico, acidemia (respiratória e metabólica), taquicardia, taquipnéia, hiperpotassemia, rabdomiólise e mioglobinúria. A dessaturação da hemoglobina no sangue arterial pode ser identificada por oximetria de pulso. Entre os diversos fatores que potencialmente contribuem para a dessaturação persistente, encontram-se acidemia, hipercarbia e hipertermia, capazes de deslocar a curva de saturação da hemoglobina para a direita. A hipercarbia, já detectada na cartografia, parece preceder as demais manifestações. A forma fulminante da Hipertermia Maligna é caracterizada por hipercapnia, rigidez muscular, hipertermias graves, e rabdomiólise, mas situações como cirurgias cardíacas sob circulação extracorpórea (CEC) com hipotermia podem atenuar a expressão clínica da Hipertermia Maligna (HM). A hiperventilação pode mascarar o diagnóstico de HM. Bloqueadores neuromusculares podem retardar o início das manifestações da crise de HM. Convém destacar que nem sempre hipertermia é manifestação inicial ou proeminente da HM. A rigidez muscular pode inexistir em 25 % dos casos, e a Hipertermia ser registrada em apenas um terço deles. A HM surge a qualquer momento durante a anestesia, tendo sido descrita sua ocorrência até 3 horas após a interrupção da exposição ao agente desencadeante (gatilho). A crise de Hipertermia Maligna (HM) pode manifestar-se tardiamente, mesmo após a interrupção da administração do agente desencadeante (gatilho), talvez a imobilidade determinada pela própria anestesia limite a liberação de cálcio a partir do retículo sarcoplasmático. Ao acordar, aumenta a atividade muscular e, na presença de resíduos anestésicos, vêm-se potencializadas à liberação intracelular de cálcio e seus efeitos metabólicos. Tem-se a impressão de haver diferenças entre os halogenados com relação ao seu potencial para desencadear crises de Hipertermia Maligna (HM). O halotano parece ser o de maior risco. A exposição ao isoflurano pode associar-se à crise de HM de início tardio. Parece que a indução da liberação de cálcio do retículo sarcoplasmático pelo sevoflurano é menos intensa em comparação aos demais agentes.
Observação de Manifestações Clínicas Iniciais: Taquicardia - 96,0%, Rigidez muscular - 83,6%, Instabilidade hemodinâmica - 85,5%, Taquipnéia - 85,0%, Cianose - 71,1%, Hipertermia - 30,0%
TERAPIA
Dada a gravidade da doença, o tratamento da Hipertermia Maligna no regime operatório deve ser iniciado em caráter de emergência. A administração do anestésico deve ser interrompida imediatamente, e o paciente deve então receber infusão intravenosa de dantroleno sódico, um relaxante muscular que restaura os níveis fisiológicos de cálcio nos músculos.
Posteriormente, o paciente é induzido a baixar a temperatura corporal por meio de fluidos frios e bolsas de gelo para evitar consequências no cérebro, e é administrado oxigênio para satisfazer o aumento da demanda do organismo. Além disso, a acidose metabólica induzida por lactato é prontamente tratada e o desequilíbrio eletrolítico corrigido. O sucesso da intervenção depende em grande parte da rapidez no reconhecimento dos sintomas e da resposta individual do paciente à terapia.
Nos últimos trinta anos, graças a novos estudos e descobertas no campo farmacológico, a taxa de mortalidade da hipertermia maligna caiu drasticamente, de 70-80 % para 5%, tornando-se uma doença relativamente manejável e tratável.
RABDOMIÓLISE EXERCICIONAL RELACIONADA AO RYR1, DOENÇA COMUM, MAS PROVAVELMENTE UMA DISFUNÇÃO DO RECEPTOR DE RIANODINA DO MÚSCULO (RYR1) SUBDIAGNOSTICADA
Rabdomiólise é uma doença caracterizada pela destruição das fibras musculares, ou seja, é a quebra do tecido muscular que leva à liberação do conteúdo das fibras musculares no sangue. A rabdomiólise é caracterizada por uma tríade de mialgia, fraqueza muscular e escurecimento da urina. Esta combinação particular de sintomas está presente em uma minoria de indivíduos. A característica é uma creatinina quinase fortemente elevada, superior a dez vezes o limite máximo. As causas mais comuns da Rabdomiólise são abuso de substâncias, medicação e trauma.
Mutações no gene do receptor de rianodina do músculo esquelético (RYR1) estão associadas a um amplo espectro de miopatias hereditárias que se apresentam ao longo da vida. A Suscetibilidade à Hipertermia Maligna (SHM) relacionadas à mutações no RYR1 tem surgido como uma causa comum de Rabdomiólise Exercicional, representando até 30% dos episódios de rabdomiólise em indivíduos saudáveis. A maioria dos indivíduos são normalmente fortes, e não têm história pessoal ou familiar de Hipertermia Maligna.
A explicação sobre o desenvolvimento da Rabdomiólise Exercicional se dá por uma falha do mecanismo de regulação da temperatura do corpo quando exposto a temperaturas excessivamente altas, podendo ser causado pelo desequilíbrio entre (1) fatores ambientais (gatilhos) e (2) predisposição (suscetibilidade). Se o indivíduo for exposto a múltiplos gatilhos, mesmo aqueles sem suscetibilidade aumentada, também podem desenvolver um episódio de rabdomiólise. Ao mesmo tempo, indivíduos com predisposição genética (suscetibilidade) à rabdomiólise poderão desenvolver um episódio da doença se não forem expostas a gatilhos suficientes.
Os gatilhos, ou fatores ambientais (1) que podem levar à Rabdomiólise Exercicional são: esforço físico excessivo (além do limiar de dor muscular/esforço físico e/ou muito mais do que seria apropriado no nível de treinamento no momento); um forte desejo ou compulsão para completar o esforço (por exemplo, em competições ou em treinamento militar); exercício quando ainda há muita dor muscular proveniente de treinamento anterior; contrações musculares excêntricas (exercícios em que o músculo se alonga durante a contração); desidratação antes, durante ou após o exercício; jejum antes do exercício; exercício em ambientes quentes;, esportes em ambiente úmido ou com roupas muito quentes (que impeçam suficientemente o calor de sair do corpo, com risco de insolação); certos medicamentos; esportes durante um episódio de gripe/infecção por uma outra forma de vírus (possivelmente com o uso de anti-inflamatórios não esteróides); e excesso de álcool, cafeína, ou outras drogas, e doping antes, ou após esforço físico.
Com relação à predisposição ou suscetibilidade (2), em alguns casos de Rabdomiólise uma causa hereditária deve ser levada em consideração, por exemplo, em episódios recorrentes da doença muito grave, em que o nível de CK permanecer elevado por muito tempo mesmo após um episódio; se não houver sinais de causas externas aparentes, ou se houver queixas na família ou histórico familiar que correspondam a uma doença muscular. Já se sabe que mutações no gene RYR1 estão associados a até 30% dos episódios de Rabdomiólise Exercicional. Sabe-se também sobre a existência de uma correlação entre a Hipertermia Maligna e a Rabdomiólise Exercicional, porém ainda em estudo. Daí nestes casos a necessidade de uma pesquisa por um diagnóstico conclusivo, feitos por exames adicionais, que podem ser através de ultrassonografia muscular, biópsia muscular, e pesquisa genética.
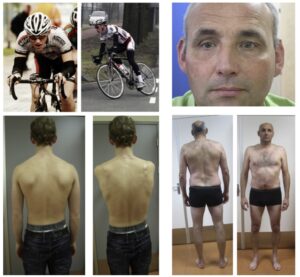
Na imagem um ciclista semi-profissional de 17 anos com histórico de episódios de Rabdomiólise de Exercicional (ERM) recorrente relacionada ao RYR1. Observe a fraqueza leve na musculatura axial. Um tio paterno portador da mesma mutação genética que apresentou no passado mialgia por esforço, também pode-se verificar no exame como tendo uma constituição muscular e ptose unilateral leve, característica de portadores da mutação genética.
Complicações - A principal complicação da Rabdomiólise Exercicional é a insuficiência renal aguda devido à obstrução tubular pela mioglobina liberada no sangue. Por causa da mioglobinúria, a urinálise será positiva para hemoglobina, mas não há eritrócitos microscópicamente visíveis. A insuficiência renal aguda ocorre em 14 a 46% dos pacientes. Outras complicações incluem síndrome compartimental, hipercalemia, hipocalcemia e insuficiência hepática. A mortalidade por rabdomiólise é de cerca de 10% dos casos.
Mecanismo de Funcionamento - Com base em estudos em modelo (camundongos), em testes de esforço/estresse por calor ambiental e miopatia, a possível fisiopatologia (funções fisiológicas da doença) da Rabdomiólise relacionada a mutações no RYR1 relacionadas a MHS (Susceptibilidade à Hipertermia Maligna), mostra que (1) os canais RYR1 são mais sensíveis e suscetíveis a eventuais ativação elétrica pelos ións de Ca, causando um vazamento de Ca2+; (2) o aumento dos níveis de [Ca2+] no citoplasma estimula a produção de Espécies Reativas de Nitrogênio; e (3) subsequente aumento da S-Nitrosilação, que; (4) por sua vez aumenta a sensibilidade à temperatura. A S-nitrosilação também diminui a sensibilidade do RYR1 à inibição do Ca2+, promovendo ainda mais o vazamento de Ca2+, isso resulta em (5) adicionais aumentos de Ca2+, e aumenta ainda mais a produção de ROS/RNS (Espécies Reativas do Oxigênio/Espécies Reativas de Nitrogênio), levando a um mecanismo de ciclo vicioso de alimentação. Finalmente, níveis cronicamente elevados de Ca2+ e ROS/RNS (Espécies Reativas do Oxigênio/Espécies Reativas de Nitrogênio) danificam as mitocôndrias e contribuem para o desenvolvimento de miopatia. Em caso de estresse por calor (6) devido ao exercício em ambientes quentes, a liberação de Ca2+ pelos receptores RYR1 mutados é grande e persistentemente aumentada, eventualmente levando à insolação. Além disso, infecções virais e drogas médicas e/ou recreativas podem reforçar também os riscos e mecanismo do ciclo de alimentação da doença. Verifique o esquema a seguir...

O texto acima foi gentilmente cedido por Dr Nicol Voermans, MD, PhD, que trabalha no Radboud University Medical Center (Holanda) com pesquisas sobre miopatias hereditárias raras. Dr Nicol, além de ter sido co-diretora do Workshop Internacional de Pesquisas em Doenças Relacionadas ao RYR1 realizado em Julho de 2022 em Pittsburgh, E.U., contribuiu com uma brilhante palestra sobre doenças relacionadas ao RYR1 na idade adulta, no caso da Hipertermia Maligna e Rabdomiólise Exercicional.
Vale destacar que o referido texto foi originalmente escrito em holandes (dutch), traduzido para o inglês, e aqui neste site, traduzido para o protuguês e contextualizado para o leitor do SORRYR-1.
DOENÇAS RELACIONADAS AO RYR-1 É UM TERMO “GUARDA-CHUVA”, OU SEJA, QUE ABRANGE ALGUMAS DIFERENTES DOENÇAS MUSCULARES
As doenças relacionadas ao RYR1 são raras, e classificadas como doenças órfãs , “órfãs”, se trata de um termo usado para identificar uma doença que afeta uma pequena percentagem da população. A verdadeira prevalência dessas doenças é difícil de calcular, pois muitos casos são mal diagnosticados ou não diagnosticados. Também há relatos de prevalência ligeiramente aumentada em certas populações étnicas e geográficas.
As doenças relacionadas ao RYR1 são devidas a uma mutação ou mutações no gene RYR-1. Na prática, podemos sintetizar o processo de mutação da seguinte maneira: o gene RYR-1 codifica o receptor RYR-1, o qual é um canal de cálcio no retículo sarcoplasmático do músculo esquelético; o fluxo de cálcio através do receptor RYR-1 é um componente crítico para a excitação-contração muscular. Uma mutação no gene RYR-1 pode alterar o número, estrutura e/ou função do receptor RYR-1, podendo assim desencadear uma ampla gama de sintomas, e consequências clínicas diferentes, que podemos chamar de doenças relacionadas ao RYR1.
As doenças relacionadas a RYR-1 (RYR1-RD) receberam, seus nomes com base na classificação histopatológica, ou seja, pela forma que músculo apareceu na biópsia sob um microscópio (por exemplo, Miopatia Central Core, Doença Multi-Minicore, Miopatia Centronuclear, e Desproporção Congênit26a do Tipo de Fibra). Além disso, muitos casos de Hipertermia Maligna (HM) ocorrem devido a uma mutação no gene RYR1. Esses vários termos têm sido uma fonte de confusão para pacientes e médicos. É fundamental lembrar que, independentemente da aparência microscópica da biópsia muscular, são necessários testes genéticos para confirmar o diagnóstico de doenças relacionadas ao RYR-1.
Doenças Relacionadas a RYR-1 (RYR-1-RD) é um termo “guarda-chuva” que abrange doenças musculares que ocorrem como resultado de mutações no gene RYR1. Estes incluem condições que historicamente receberam seus nomes com base na classificação histopatológica, ou seja, como a biópsia muscular apareceu sob um microscópio (por exemplo, doença do núcleo central, doença de múltiplos minicores, miopatia centronuclear e desproporção do tipo de fibra congênita. hipertermia maligna (HM) é devido a uma mutação no gene RYR1.
Miopatia Central Core - Central Core Disease (CCD)
Verifique os tipos de Doenças Relacionadas ao RYR1 a seguir...
Miopatia Central Core - Central Core Disease (CCD)
Miopatia Central Core (CCD) é o termo usado pelos patologistas para descrever o tecido de biópsia muscular desprovido de uma mancha específica no meio de uma fibra muscular, dando a aparência de "núcleo". A CCD causa uma fraqueza muscular que varia de quase assintomática a muito grave. A maioria das pessoas com CCD experimentam fraqueza muscular leve e persistente que pode piorar com o tempo. Essa fraqueza afeta os músculos próximos ao centro do corpo (músculos proximais), particularmente os músculos das coxas e quadris. A fraqueza muscular também pode fazer com que os bebês afetados pareçam "moles" e pode atrasar o desenvolvimento de suas habilidades motoras, como sentar, levantar e andar. Em casos graves, os bebês afetados apresentam tônus muscular profundamente fraco (hipotonia), resultando em dificuldades de alimentação e problemas respiratórios graves ou com risco de vida. O CCD também está associado a anormalidades esqueléticas, como curvatura anormal da coluna vertebral (escoliose), luxação do quadril e deformidades articulares chamadas contraturas que restringem o movimento de certas articulações. Indivíduos com CCD tendem a permanecer ambulatoriais durante toda a vida.
Doença Multi-Minicore (MmD)
A Doença Multi-minicore (MmD) é uma doença que clinicamente causa fraqueza muscular e problemas de saúde relacionados, que variam de leves a fatais. Os pesquisadores identificaram pelo menos quatro formas de MmD, que podem ser distinguidas por seus sinais e sintomas característicos. A forma mais comum, chamada de forma clássica, causa fraqueza muscular começando na primeira infância. Essa fraqueza é mais perceptível nos músculos do tronco e pescoço (músculos axiais), e é menos grave nos músculos dos braços e pernas. A fraqueza muscular faz com que os bebês afetados pareçam "moles" (hipotônicos) e podem atrasar o desenvolvimento de habilidades motoras, como sentar, ficar em pé e andar. A doença faz com que os músculos da parede torácica e da coluna endureçam. Quando combinada com a fraqueza dos músculos necessários para respirar, essa rigidez leva a problemas respiratórios graves ou com risco de vida. Quase todas as crianças com MmD desenvolvem uma curvatura anormal da coluna vertebral (escoliose), que aparece durante a infância e piora constantemente ao longo do tempo. Deve-se notar que certos indivíduos com MmD têm mutações no gene RYR-1, enquanto outros indivíduos têm mutações em outros genes (por exemplo, SEPN1).
Miopatia Congênita Centronuclear - Centronuclear Myopathy (CNM)
A Miopatia Congênita Centronuclear (CNM), tem sido associada a várias condições genéticas diferentes, incluindo mutações no RYR-1. Indivíduos com CNM geralmente começam a sentir fraqueza muscular a qualquer momento, desde o nascimento até o início da idade adulta. Muitos dos sintomas da CNM coincidem com os da Central Core (CCD). A fraqueza muscular causada pela CNM pode levar ao atraso no desenvolvimento de habilidades motoras (engatinhar ou andar) e pode ser lentamente progressiva. Algumas pessoas afetadas podem precisar de assistência em cadeira de rodas. Outros sintomas incluem: problemas respiratórios leves a graves, ptose (queda da pálpebra superior), fraqueza nos músculos faciais, anormalidades nos pés, um arco alto no céu da boca (palato arqueado) e escoliose.
Desproporção Congênita do Tipo de Fibra - Congenital Fiber - Type Disproportion (CFTD)
Indivíduos com a doença da Desproporção Congênita do Tipo de Fibra (CFTD), geralmente experimentam fraqueza muscular, principalmente nos músculos dos ombros, braços, quadris e coxas. A fraqueza também pode afetar os músculos da face, músculos que controlam os movimentos oculares (oftalmoplegia) e músculos da pálpebra superior (ptose). Os indivíduos com CFTD geralmente têm uma face longa, um arco alto no céu da boca (palato arqueado alto) e dentes apinhados. Os indivíduos afetados podem ter deformidades articulares (contraturas) e uma região lombar anormalmente curvada (lordose) ou uma coluna que se curva para o lado (escoliose). Aproximadamente 30% das pessoas com esse distúrbio apresentam problemas respiratórios leves a graves relacionados à fraqueza dos músculos necessários para respirar. Algumas pessoas que experimentam esses problemas respiratórios precisam do uso de uma máquina para ajudar a regular a respiração à noite e, ocasionalmente, durante o dia. Cerca de 30% dos indivíduos afetados têm dificuldade em engolir devido à fraqueza muscular na garganta. Raramente, as pessoas com essa condição têm um músculo cardíaco enfraquecido e aumentado (cardiomiopatia dilatada).
Suscetibilidade a Hipertermia Maligna - Malignant Hyperthermia Susceptibility (MH)
Indivíduos sensíveis à Hipertermia Maligna (MH) podem experimentar uma vida diária normal sem qualquer sintoma ou fraqueza muscular. No entanto, quando expostos a certos agentes anestésicos, os pacientes podem experimentar um episódio de Hipertermia Maligna. A Hipertermia Maligna caracteriza-se por um estado hipermetabólico, causando um aumento anormal do calor, com rigidez excessiva e quebra muscular associada, e aumento da frequência cardíaca. As complicações graves da HM incluem: lesão cerebral, sangramento interno, parada cardíaca e/ou falência de múltiplos órgãos. As complicações cardiovasculares associadas podem ser fatais. Qualquer indivíduo com uma mutação(ões) do RYR-1, se a anestesia for necessária para um procedimento médico-cirúrgico, é aconselhado a tomar "precauções contra hipertermia maligna". Indivíduos com mutações RYR-1 suscetíveis a MH também correm risco de rabdomiólise, bem como outras dores e cãibras musculares relacionadas ao calor e ao esforço. Rabdomiólise é o termo geral para ruptura muscular associada a uma ampla variedade de gatilhos externos, incluindo: exercícios extenuantes além do limite de fadiga, abuso de drogas ou álcool, uso de suplementos ou certos medicamentos, doença viral recente ou trauma muscular. Os sinais e sintomas da rabdomiólise incluem dor muscular intensa, elevação repentina e queda subseqüente dos níveis séricos de creatina fosfoquinase (CPK) e produtos da quebra muscular na urina ("mioglobinúria"). O curso da rabdomiólise é caracterizado principalmente por mialgia (dor muscular) com aumentos leves a moderados da CPK. Nesses casos leves, muitos indivíduos não procuram atendimento médico. No entanto, em alguns o curso clínico é grave, resultando em hiper-CK-emia profunda, insuficiência renal aguda, síndrome do compartimento, coagulação intravascular disseminada, arritmias cardíacas secundárias a desequilíbrios eletrolíticos e, possivelmente, parada cardíaca se não tratada. Portanto, indivíduos com mutações no RYR-1, especialmente aquelas conhecidas por estarem associadas à suscetibilidade ao HM, devem estar cientes dos gatilhos da rabdomiólise e podem querer consultar um médico antes do início de um regime de exercícios e/ou esportes. Pode haver um papel do dantroleno como agente profilático na prevenção da rabdomiólise e de outros sintomas musculares relacionados ao esforço e ao calor.