Buscando estar sempre conectado com as notícias relacionadas e de interesse dos portadores de mutação no gene RYR1, mais especificamente a Miopatia Congênita Centronuclear, que se trata da doença que me acomete, tomei conhecimento da recente pré-publicação científica, intitulada, “O Propofol liga-se diretamente e inibe o receptor 1 de rianodina do músculo esquelético (RYR1)”, versão postada em 12 de janeiro de 2024, na qual os pesquisadores, Thomas T. Joseph, MD, PhD¹, Weiming Bu, PhD¹, Omid Haji-Ghassemi, PhD², Yu Seby Chen, PhD², Kellie Woll, PhD², Paul D. Allen, MD, PhD⁴, Grace Brannigan, PhD³, Filip Van Petegem, PhD², Roderic G. Eckenhoff, MD¹, através de resultados obtidos em estudos e ensaios sugerem em seus relatos que o propofol, um agente anestésico intravenoso de curta ação, em concentrações clínicas, se liga ao receptor de rianodina tipo 1 (RYR1), inibindo sua abertura, podendo assim, prevenir as manifestações clínicas da Hipertermia Maligna (HM), mesmo com exposição a agentes desencadeantes como os anestésicos voláteis.
Confira a integra da publicação pelo seguinte link: https://www.biorxiv.org/content/10.1101/2024.01.10.575040v1.full
O receptor de rianodina tipo 1 (RYR1) desempenha um papel central na determinação de quando (tempo), e quanta (quantidade) força é produzida pelos músculos esqueléticos, que é necessária e essencial para movimentação do corpo e atividades físicas diárias dos indivíduos. Como principal canal de liberação de íon de cálcio (Ca²⁺) no retículo sarcoplasmático do músculo esquelético, a mutação genética no receptor de rianodina tipo 1 (RYR1), tem a ela subjacentes, algumas doenças ou distúrbios musculares, tais como a Miopatia Centronuclear, Miopatia Central Core, Miopatia Multi-Minicore, Desproporção Congênita do Tipo de Fibra, incluindo distúrbios como a Rabdomiólise por Esforço, e a Hipertermia Maligna (HM).
Em pacientes com a mutação no gene RYR1, “a crise” de Hipertermia Maligna, causada pela exposição a algumas drogas desencadeantes, como os anestésicos voláteis halogenados, pode direcionar o RYR1 a deixar o canal de rianodina em um estado aberto, resultando em uma liberação descontrolada de Ca²⁺, acarretando em tensão no sarcômero, e consequente produção de calor. A restauração de Ca²⁺ no retículo sarcoplasmático também consome ATP (adenosina trifosfato), molécula responsável pelo depósito de energia celular, gerando também por consequência uma carga metabólica adicional insustentável.
Ao anestesiar pacientes com mutações genéticas conhecidas pela suscetibilidade a Hipertermia Maligna, o anestésico geral intravenoso não desencadeante propofol é comumente substituído por anestésicos desencadeantes. As evidências de ligação direta de agentes anestésicos ao RYR1 ou seus parceiros de ligação são escassas, e as interações em nível atômico do propofol com o RYR1 são totalmente desconhecidas. Os pesquisadores mostram no trabalho acima descrito que o propofol diminui a abertura do receptor do canal de rianodina (RYR1) com vesículas no retículo sarcoplasmático e bicamadas lipídicas planas, e que inibe a liberação de Ca²⁺ induzida por ativador do retículo sarcoplasmático no músculo esquelético humano. Além de confirmar a ligação direta, a marcação por fotoafinidade usando m-azipropofol (AziPm) revelou vários supostos locais de ligação de propofol no RYR1. A projeção pela simulação dinâmica da afinidade de ligação molecular sugere que o propofol se liga a pelo menos um destes locais em concentrações clínicas. Esses achados convidam à hipótese de que, além de o propofol não desencadear a Hipertermia Maligna, ele também pode ser protetor contra a Hipertermia Maligna, inibindo o fluxo induzido de Ca²⁺ através do canal de rianodina - RYR1.
¹ Department of Anesthesiology and Critical Care, Perelman School of Medicine, University of Pennsylvania, Philadelphia, PA USA; ² Department of Biochemistry, University of British Columbia, Vancouver, BC, Canada; ³ Department of Physics and Center for Computational and Integrative Biology, Rutgers University, Camden, NJ USA; ⁴ Department of Anesthesiology, University of Tennesee, Knoxville, TN USA
O artigo acima mencionado foi publicado na bioRxiv, repositório aberto de pré-publicação direcionado as ciências biológicas (https://www.biorxiv.org/), e hospedado pelo Cold Spring Harbor Laboratory (CSHL).
As doenças relacionadas ao RYR1 são identificadas com base em sua classificação histopatológica, isto é, pela aparência da biópsia do músculo na lâmina do microscópio. A diferenciação encontrada na biópsia designará o tipo da doença, se é por exemplo, Miopatia Central Core, Miopatia Multiminicore, Miopatia Centronuclear, ou Desproporção Congênita de Tipos de Fibras.
A Miopatia Congênita Centronuclear (MCCN) e a Miopatia Central Core (MCC) são ambas doenças musculares hereditárias causadas por mutações genéticas. A MCCN pode estar associada a mutações em diferentes genes, no DNM2, BIN1, MTM1, e RYR1, já a MCC está associada somente ao gene RYR1.
Esses tipos de doenças relacionadas ao RYR1 variam amplamente em termos dos seus diferentes sinais e sintomas, de quando eles inicialmente se apresentaram, além da sua respectiva gravidade. Embora sejam altamente variáveis, os sintomas presentes também dependem se a mutação do gene RYR1 é autossômica dominante ou autossômica recessiva.
Uma pergunta que sempre chega até mim é sobre as diferenças entre a Miopatia Centronuclear e a Miopatia Central Core. Assim, eu, enquanto portador da Miopatia Congênita Centronuclear (MCN), buscarei esclarecer pontualmente neste texto, me atendo ao tipo que me acomete, que é a pela mutação no gene RYR1.
Estas doenças apesar de terem sintomas parecidos e compartilharem de algumas características clínicas em comum, se confundem entre si, e apresentam com algumas diferenças distintas:
Miopatia Congênita Centronuclear (MCCN)
Miopatia Central Core (MCC)
Em resumo, a Miopatia Congênita Centronuclear e a Miopatia Central Core, ambas doenças relacionada ao RYR1, têm seus sintomas e sinais físicos que podem se parecer, podem se confundir, mas são diferentes, a contar da análise histológica das células musculares em uma biópsia, exame este que é crucial para diferenciar entre as duas condições e determinar o diagnóstico correto, conduta médica, tratamento, e até prognóstico de evolução.
Nota: todo o material escrito nesta página é oriundo de pesquisa científica, e conclusões próprias do autor deste website, que convive como portador, desde o nascimento, com a Miopatia Congênita Centronuclear causada pela mutação no gene RYR-1
ARMGO PHARMA PÚBLICA IMPORTANTES E POSITIVOS RESULTADOS DO ENSAIO DE FASE 1B DO RYCALl® ARM210 PARA O TRATAMENTO DE MIOPATIAS RELACIONADAS AO RECEPTOR DE RIANODINA 1
ARMGO Pharma, Inc. (ARMGO), uma empresa privada no setor biofarmacêutico que desenvolve uma nova classe de drogas de moléculas pequenas ou micro moléculas conhecidas como Rycals®, anunciou em 29 de janeiro de 2024 a publicação dos resultados de um estudo de Fase 1b de seu Rycal ARM210 (também conhecido como S48168), para o tratamento de miopatias relacionadas ao receptor 1 de Ryanodina (RYR1-RM), uma doença muscular órfã, também chamada de “doença rara”, por ser uma doença que afeta uma pequena percentagem da população.
2024 a publicação dos resultados de um estudo de Fase 1b de seu Rycal ARM210 (também conhecido como S48168), para o tratamento de miopatias relacionadas ao receptor 1 de Ryanodina (RYR1-RM), uma doença muscular órfã, também chamada de “doença rara”, por ser uma doença que afeta uma pequena percentagem da população.
Os dados foram publicados em um artigo intitulado 'Rycal S48168 (ARM210) para Miopatias Relacionadas ao RYR1: um ensaio de fase um, estudo em aberto, e de ensaio de escalonamento de dose', de autoria do Dr. Joshua Todd et al, no Journal eClinicalMedicine, parte da família de publicações Lancet. O artigo revisa os dados do estudo de Fase 1b do ARM210 e seu novo mecanismo de ação alostérico (MoA) visando a causa raiz da doença relacionada ao RYR-1 (RYR1-RM): mutação do Receptor 1 de Ryanodina (RYR1).
O gene RYR1 que codifica o Receptor 1 de Ryanodina RYR1, um canal intracelular de liberação de cálcio, vaza em doenças musculares. Vazamentos intracelulares de cálcio causados por canais RYR1 com mutação prejudicam a contração muscular, levando à fraqueza muscular e perda de função, e ativam vias tóxicas que danificam os músculos, causando os sintomas das doenças relacionadas ao RYR1.
O ensaio de Fase 1b, aberto, de escalonamento de dose confirmou a segurança, tolerabilidade e farmacocinética da dosagem de 120 e 200 mg de ARM210 diariamente durante 29 dias em homens e mulheres adultos afetados pelas doenças relacionadas ao RYR1 (RYR1-RM).
É importante ressaltar que o estudo também demonstrou eficácia preliminar no grupo de dose mais alta em dois sintomas característicos das doenças relacionadas ao RYR1 (RYR1-RM): 1) alívio significativo da fadiga avaliada pelo sistema PROMIS-fatigue (Patient-Reported-Outcome Measurement Information System) t-scores, e 2) melhora da força dos proximais avaliada pelo exame físico de abdução do ombro (Medical Research Council Grading). Estes resultados justificam o desenvolvimento futuro do ARM210 como um potencial tratamento e modificador da doença para as miopatias relacionadas ao RYR1 (RYR1-RM) em um ensaio de Fase 2 randomizado e controlado por placebo.
O ensaio de Fase 1b concluído foi conduzido em colaboração com o National Institute of Neurological Disorders and Stroke (NINDS) e National Institute of Health (NIH) sob um Acordo Cooperativo de Pesquisa e Desenvolvimento (CRADA - Cooperative Research and Development Agreement ), com o apoio da Fundação RYR-1, Pittsburgh, PA, EUA.

(Foto esquerda para direita: Dr. Tokunbor Lawal (autor da publicação), Dr. Mike Goldberg (co-fundador/Co-presidente de Pesquisas da Fundação RYR-1), e Dr. Payam Mohassel (Pesquisador Principal e Autor Senior)).
“Estamos muito satisfeitos com os resultados do ensaio com as doenças relacionadas ao RYR1 (RYR1-RM) conduzido em conjunto com o NIH, pois o estudo confirmou a segurança e tolerabilidade do ARM210, mas o mais importante, demonstrou pela primeira vez que o nosso Rycal®, ARM210, pode reverter os sintomas desta doença muscular crônica e devastadora em um curto período de tratamento. Isso é muito promissor”, disse Gene Marcantonio, M.D., Ph.D., CEO da ARMGO Pharma. “Esperamos, portanto, continuar rapidamente no desenvolvimento do ARM210 para levar este primeiro e potencial tratamento aos pacientes com as doenças relacionadas ao RYR1, com o apoio da Fundação RYR-1 e da comunidade de pacientes.”
Michael F. Goldberg, MD, MPH, co-presidente de pesquisa da Fundação RYR-1 acrescentou: “Estamos entusiasmados com a publicação deste importante estudo, pois representa um farol de esperança para muitos indivíduos e famílias de todo o mundo afetados pelas doenças relacionadas ao RYR1. Estamos ansiosos pelas próximas etapas de ensaios no desenvolvimento dessa importante droga.”
Mais informações sobre este estudo de Fase 1b podem ser encontradas online em: https://clinicaltrials.gov/study/NCT04141670. O ensaio foi apoiado pelos Programas de Pesquisa Intramural do NIH/NINDS, NIH/NINR, um NIH Clinical Center Bench to Bedside Award (2017-551673) e pelo parceiro de colaboração anterior da ARMGO, Les Laboratoires Servier. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente a opinião oficial dos Institutos Nacionais de Saúde.
BREVE REVISÃO SOBRE A FUNÇÃO DO RYR1 E DOENÇAS RELACIONADAS
Os RYRs são canais homotetraméricos de liberação de cálcio intracelular responsáveis pelo fluxo de Ca2+ dos retículos sarcoplasmáticos/endoplasmáticos (RS/RE) para o citoplasma da maioria dos tipos de células. RYR1 é a isoforma predominante no músculo esquelético de mamíferos, onde a liberação de Ca2+ via RYR1 é necessária para o acoplamento excitação-contração e função muscular normal. Já o RYR2 é a isoforma predominante no músculo cardíaco onde a liberação de Ca2+ via RYR2 é necessária para a função normal do músculo cardíaco. Mutações genéticas humanas nos genes RYR1 e RYR2 fazem com que o cálcio vaze dos canais RYR, levando à doença (Figura 1).
Os canais RYR normalmente alternam entre um estado de repouso (fechado) e excitado (aberto). Em certas doenças, em que existe a mutação genética, o RYR é modificado e torna-se incontinente ou seja, fica vazando. No caso do RYR1, este desempenha um papel crítico no músculo esquelético, e as mutações do RYR1 em humanos levam a uma miopatia progressiva, conhecida como doenças relacionadas ao RYR1 (RYR1-RM), privando o músculo da capacidade de responder eficazmente aos sinais de contração, levando à fraqueza muscular.
Sobre o Rycals® - A inibição do canal interromperia o vazamento, mas esta intervenção geralmente não seria benéfica, uma vez que bloquearia a função normal do RYR. O Rycals®, são moléculas que podem restaurar a função normal do canal sem bloquear o RYR, e abrem a possibilidade de intervenções terapêuticas.
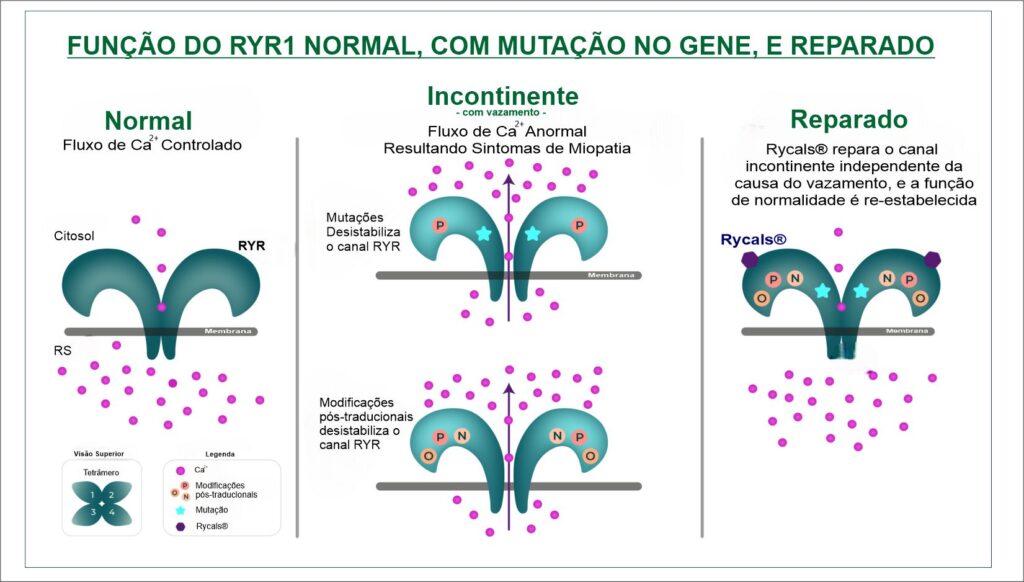
Figura 1: Modelo da função do RYR. O RYR controla o fluxo de cálcio (Ca2+) de dentro do retículo sarcoplasmático (RS) através da membrana até o citoplasma. (Quadro Esquerdo) O RYR normal regula o fluxo de cálcio alternando entre um estado fechado e aberto. (Quadro Meio) Na RYR1-RM, o RYR mutado apresenta vazamento, levando ao fluxo anormal de cálcio, resultando em sintomas da doença. Modificações pós-traducionais* (MPTs) do RYR agravam ainda mais o vazamento. Em outros distúrbios musculares, como DMD, insuficiência cardíaca ou sarcopenia, as modificações pós-traducionais (MPTs) do RYR podem causar vazamento no canal, levando a um fluxo anormal de cálcio, resultando em sintomas da doença. (Quadro Direito) Rycals® liga-se aos canais incontinentes (com vazamento) e repara o vazamento independentemente da causa do vazamento, restaurando a função normal do canal. O Rycals® não bloqueia o RYR.
*As modificações pós-traducionais (MPTs) são modificações químicas e estruturais de uma cadeia proteica após a sua tradução. Estas modificações podem determinar a atividade, a localização e interações com outras proteínas.
Recentemente foi publicado um artigo médico-científico tratando sobre a Pancreatite em Indivíduos com Doenças Relacionadas ao RYR1. O estudo teve participação de pesquisadores do Reino Unido, Holanda e Estados Unidos, além do nobre apoio da Fundação RYR1.
Mutações no gene do receptor de rianodina do músculo esquelético (RYR1) são uma causa comum de doenças neuromusculares hereditárias e têm sido associadas a um amplo espectro de fenotípico, variando de várias miopatias congênitas de início precoce com fraqueza muitas vezes substancial, até fenótipos induzidos em indivíduos “normalmente fortes” tais como a Rabdomiólise por Esforço (ERM) e suscetibilidade aos efeitos relacionados à anestesia, como a Hipertermia Maligna (HM). O gene RYR1 codifica o principal canal de liberação de cálcio do retículo sarcoplasmático (SR) com um papel crucial
no acoplamento excitação-contração (ECC), processo pelo qual um impulso neuronal elétrico é traduzido em contração muscular por meio da liberação de cálcio intracelular, estimulando o filamento contrátil. Mutações no gene RYR1 associadas à fraqueza muscular permanente normalmente prejudicam o processo excitação-contração (ECC) de forma eficaz, enquanto aquelas associadas com ERM e MH resultam em um receptor RYR1 hiperexcitável e muitas vezes aumenta desproporcionalmente a liberação de cálcio.
Os genes RYR1s foram implicados em processos essenciais de sinalização de cálcio em uma ampla gama de tecidos, mas as manifestações de doenças humanas associadas ao mau funcionamento do RYR1 em outros órgãos além do músculo esquelético até agora receberam pouca atenção. Descobriu-se que os genes RYR1s são amplamente expressos no pâncreas de mamíferos, através de seu papel nos processos de sinalização de cálcio intracelular, e têm sido criticamente implicados na função pancreática endócrina e exócrina.
No estudo foi relatado três casos com características principais de um distúrbio relacionado ao RYR1 e uma história adicional de pancreatite (aguda) inexplicável, sugerindo uma nova associação clínica de função perturbada do RYR1 não relacionada ao músculo estriado. Os três pacientes com diagnóstico de Miopatia Central Core (CCD), Síndrome de King-Denborough (KDS) e Suscetibilidade à Hipertermia Maligna (MHS), respectivamente, que além de seu (suposto) distúrbio relacionado ao RYR1 também desenvolveram sintomas e sinais de pancreatite aguda. Em dois pacientes, os episódios foram recorrentes, com grave envolvimento multissistêmico e sequelas. A sinalização de cálcio mediada por RYR1 desempenha um papel importante na função pancreática normal, mas também tem sido criticamente implicada na fisiopatologia da pancreatite aguda, particularmente nas formas induzidas por ácidos biliares e etanol. Os resultados de modelos animais relevantes indicam que os danos pancreáticos nestas condições podem ser melhorados através da administração do antagonista específico de RYR1, dantroleno, e de outros compostos que modificam o metabolismo pancreático, incluindo a sinalização de cálcio. Estas observações sugerem que os pacientes com variantes de ganho de função do RYR1 podem ter um risco aumentado de desenvolver pancreatite aguda, uma condição que deve, portanto, ser considerada na vigilância da saúde desses indivíduos.
Saiba mais detalhes sobre o tema
deste texto lendo a publicação
completa no artigo científico
clicando na imagem ao lado ⇒
A terapia genética que era tida como uma futura grande promessa para o tratamento de miopatias relacionadas ao RYR1, se torna uma realidade com a publicação do recente relato científico da primeira correção por Edição Prime de uma mutação no gene RYR1.
A Fundação RYR-1 (https://ryr1.org/) cumprimentou a todos no início de ano com um “Feliz 2024, mas também compartilhou a informação que financiou uma pesquisa incrivelmente importante com o Dr. Jacques P. Tremblay, um pesquisador na Universidade Laval em Quebec. As descobertas e resultados dos trabalhos de pesquisa acabaram de ser publicadas em um novo artigo de  pesquisa (https://www.mdpi.com/2073-4409/13/1/31#). E o resultado é ainda mais emocionante, pois os pesquisadores utilizaram com sucesso a Edição Prime, uma forma de edição genética, que foi utilizada para corrigir uma mutação no gene RYR1 nas células musculares esqueléticas. Esta pesquisa fornece "prova de conceito" para a edição de genes como sendo uma estratégia em potencial para tratar miopatias relacionadas com RYR-1, que atualmente carecem de terapias eficazes. Segundo o cientista, "estes resultados são as primeiras demonstrações de que é possível corrigir mutações no gene RYR-1"
pesquisa (https://www.mdpi.com/2073-4409/13/1/31#). E o resultado é ainda mais emocionante, pois os pesquisadores utilizaram com sucesso a Edição Prime, uma forma de edição genética, que foi utilizada para corrigir uma mutação no gene RYR1 nas células musculares esqueléticas. Esta pesquisa fornece "prova de conceito" para a edição de genes como sendo uma estratégia em potencial para tratar miopatias relacionadas com RYR-1, que atualmente carecem de terapias eficazes. Segundo o cientista, "estes resultados são as primeiras demonstrações de que é possível corrigir mutações no gene RYR-1"
O gene RYR1 codifica um canal de cálcio denominado receptor 1 de Ryanodina, apresentada nas fibras musculares esqueléticas. A falha desse canal causa fraqueza muscular, que degenera acarretando deficiências motoras no indivíduo afetado. Atualmente, não existem tratamentos eficazes para estas miopatias, também conhecidas como doenças relacionadas ao RYR1, que são causadas principalmente por mutações pontuais. A Edição Prime permite a modificação precisa de nucleotídeos no DNA. Os resultados dos trabalhos de pesquisa pelos cientistas Kelly Godbout, Joël Rousseau e Jacques P. Tremblay, demostraram uma taxa de correção de 59% da mutação T4709M no gene RYR1 em mioblastos humanos pela entrega de RNA dos componentes de Edição Prime. Deve-se notar que o T4709M é recessivo e, portanto, as pessoas com mutação heterozigótica são saudáveis. Estes resultados são a primeira demonstração de que é possível corrigir mutações no gene RYR1.
A tecnologia de Edição Prime pode ser usada para corrigir mutações que causam miopatias relacionadas ao RYR1. Este grupo de doenças inclui a Hipertermia Maligna (HM), Miopatia Central Core (CCD), Miopaty Multi-Minicore (MmD), Miopatia Centronuclear (CNM), Desproporção Congênita do Tipo de Fibra (CFTD) e Rabdomiólise por Esforço (ERM). Até o momento, mais de 700 variantes no gene RYR1 foram identificadas. Este gene que codifica uma proteína chamada "receptor de rianodina 1" (RyR1), é o principal canal de cálcio no retículo sarcoplasmático (SR) nas fibras musculares esqueléticas. A disfunção desta proteína afeta o fluxo de cálcio para os músculos. A posição da mutação não afetará ou impactará na proteína, mas as mutações nos genes farão com que ocorra principalmente a um vazamento de cálcio. E como o cálcio é fundamental para a contração muscular, essa desregulação do RYR1 leva à fraqueza muscular, caibras, exaustão, intolerância ao calor, dificuldades respiratórias e até mesmo à reação maligna de hipertermia, ou Hipertermia Maligna. Essas miopatias, portanto, afetam gravemente a qualidade de vida dos pacientes. A proteína RYR1 tem variações funcionais limitadas, e o gene RYR1 é um dos mais intolerantes a variações de sequência no genoma humano.
Até o momento, não existe tratamento eficaz para essas doenças relacionadas ao RYR1. Como muitas mutações nos genes RYR1 são mutações pontuais, os resultados descritos no referido artigo demonstram claramente que a Edição Prime pode ser utilizada para corrigi-las, uma vez que pode substituir qualquer nucleotídeo do genoma.
O referido artigo relata a correção de uma dessas mutações (isto é, a T4709M) como exemplo. Esta mutação específica foi selecionada porque existe um modelo de camundongo (RYR1TM/Indel) com essa mutação que desenvolve sintomas claros. Confira o artigo científico no link -> https://www.mdpi.com/2073-4409/13/1/31#
TERAPIA GENÉTICA
A terapia genética é uma grande promessa para o tratamento de doenças genéticas, uma vez que aborda diretamente a raiz do problema. Ao corrigir mutações, a terapia genética tem o potencial de curar milhares de doenças hereditárias.
A descoberta do CRISPR/Cas9 em 2012 foi um marco no desenvolvimento de terapias genéticas. O Crispr/Cas9 é uma espécie de "tesoura genética", que permite à ciência mudar parte do código genético de uma célula. Com essa "tesoura", é possível, por exemplo, "cortar" uma parte específica do DNA, fazendo com que a célula produza ou não determinadas proteínas.
Este sistema usa uma nuclease Cas9 que induz uma quebra da fita dupla do DNA em um local preciso do genoma. Cas9 é direcionado para a sequência do genoma desejada por um único RNA guia (sgRNA). Este sgRNA é um RNA de fita simples complementar a uma sequência de DNA. A proteína Cas9 forma um complexo com o sgRNA e se liga a um motivo adjacente no DNA, induzindo um corte. Após a quebra da cadeia dupla no local do desejado, a célula irá reparar este corte por Reparação Dirigida por Homologia (HDR) se for fornecida uma sequência doadora. No entanto, a percentagem de correção de uma mutação precisa de nucleótidos por HDR é demasiado baixa para ser utilizada no tratamento de doenças hereditárias in vivo . Se nenhuma sequência doadora for fornecida, a célula reparará o corte por junção final não homóloga (NHEJ) e produzirá indels. InDels (inserções e deleções) são adições ou perdas de uma ou mais bases consecutivas na sequência do DNA.
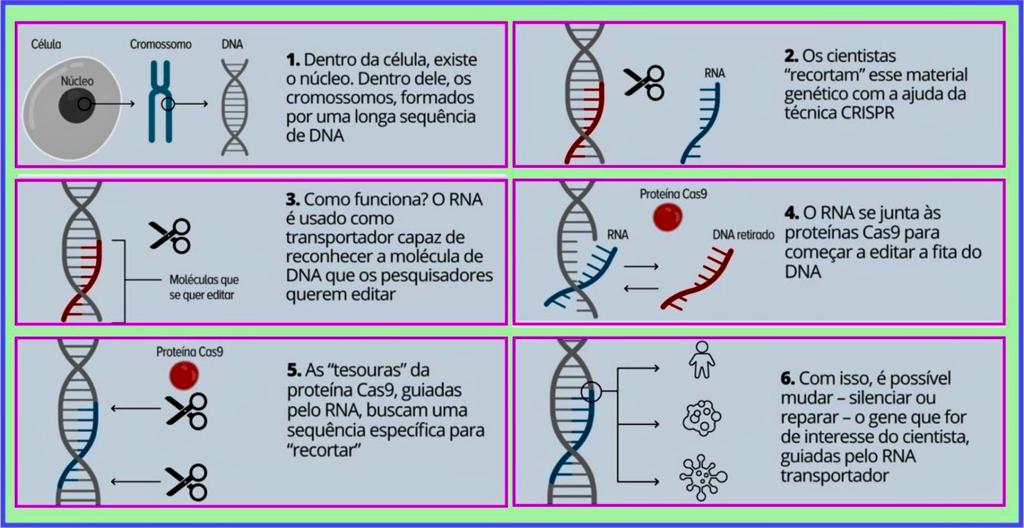
CRISPR/Cas9
Em outubro de 2019, o grupo de David R. Liu publicou uma técnica notável chamada PRIME EDITION. Este sistema pode realizar inserções, deleções direcionadas e todas as 12 conversões de base possíveis.
O Prime Edition ou sistema Edição Prime (em português), é um método de edição de genoma que grava diretamente novas informações genéticas em um local (endereço) de DNA especificado usando uma endonuclease Cas9 prejudicada cataliticamente e fundida com uma transcriptase reversa projetada, programada com um RNA de guia Prime Edition (pegRNA) que especifica o local de destino e codifica a edição desejada. Esta tecnologia realiza modificações no DNA com precisão sem precedentes e oferece vantagens substanciais sobre o sistema tradicional CRISPR/Cas9.
Prime Editing é mais complexo que a edição CRISPR. Ele pode excluir comprimentos longos de DNA causador de doença ou inserir DNA para reparar mutações perigosas, tudo sem desencadear as respostas caóticas (e possivelmente prejudiciais) do genoma introduzidas por outras formas de CRISPR.
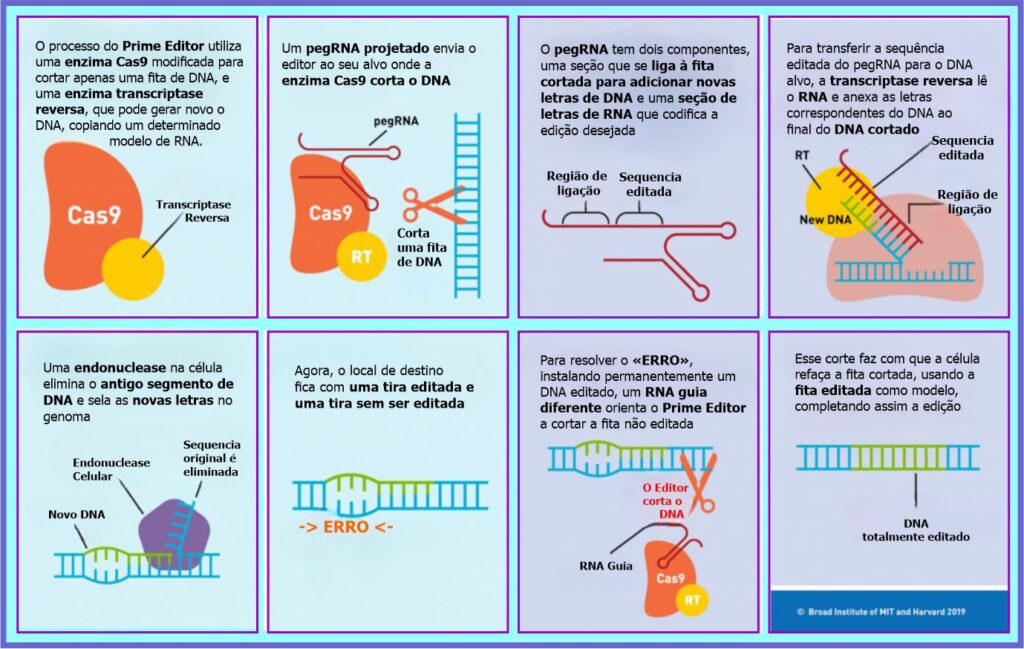
Prime Edition
Em resumo, a técnica CRISPR-Cas9, popularmente utilizada para modificação genética pela comunidade científica, baseia-se na atividade nuclease da enzima Cas9 que corta as duas fitas de DNA, e utiliza a maquinaria de reparo de danos da própria célula. No entanto, o sistema de reparo pode inserir ou deletar letras de DNA, causando efeitos inesperados. Já a nova tecnologia “Prime Editing” ou Edição Prime utiliza uma versão enzima Cas9 que além de reconhecer sequências específicas de DNA, corta apenas uma das fitas da dupla-hélice. Dessa forma, a edição ocorre no local correto do corte através da ação de uma enzima transcriptase e uma fita de RNA guia (pegRNA).
Recentemente me submeti a uma colonoscopia e endoscopia no Hospital Israelita Albert Einstein, um exame de rotina, mas dado a minha questão com a suscetibilidade a Hipertermia Maligna, os procedimentos foram feitos cercados por forte critérios de segurança, contudo, infelizmente dado ao pouco conhecimento sobre essa doença, esse protocolo de seguranaça é observado em poucas instituições hospitalar.
A Hipertermia Maligna (HM) é uma condição rara e séria, a qual pode ser desencadeada pela administração de certos anestésicos. Os indivíduos com mutação no gene RYR1 têm a  suscetibilidade em ter o episódio de HM. O episódio de HM se não atendido no momento certo, com as drogas e procedimentos corretos pode ser fatal. É muito importante destacar que atualmente já existem identificados anestésicos que devem ser evitados, contudo, por ser uma doença pouco conhecida, além de se evitar essas drogas, os cuidados em qualquer procedimento médico envolvendo anestesia, deve ter uma atenção dobrada. A aplicação de anestesia não se restringe a procedimentos cirúrgicos, mas também em entubação, pequenas intervenções em pronto-socorro, dentre outros.
suscetibilidade em ter o episódio de HM. O episódio de HM se não atendido no momento certo, com as drogas e procedimentos corretos pode ser fatal. É muito importante destacar que atualmente já existem identificados anestésicos que devem ser evitados, contudo, por ser uma doença pouco conhecida, além de se evitar essas drogas, os cuidados em qualquer procedimento médico envolvendo anestesia, deve ter uma atenção dobrada. A aplicação de anestesia não se restringe a procedimentos cirúrgicos, mas também em entubação, pequenas intervenções em pronto-socorro, dentre outros.
Diante do exposto, se alguém tem suscetibilidade à Hipertermia Maligna, é crucial comunicar isso à equipe médica antes da anestesia. Seguem alguns cuidados a serem considerados:
Os portadores de doenças relacionadas ao RYR-1 através do SORRYR-1 comemoram junto com a comunidade dos portadores de Distrofia Muscular, em especial os Duchennes, pela recente aprovação pelo FDA (Federal Drug Administration) do ELEVIDYS (delandistrogene moxeparvovec-rokl) destinada ao tratamento de pacientes pediátricos ambulatorial com idades entre os 4 e os 5 anos com Distrofia Muscular tipo Ducehene #Duchenne #MuscularDystrophy (#DMD) com mutação confirmada no gene DMD.
O SORRYR-1 cumprimenta também a Sarepta Therapeutics @sareptatherapeutics pelo importante trabalho em pesquisas e desenvolvimento de medicamentos genéticos de precisão potencialmente transformadores para doenças raras. O ELEVIDYS é a primeira terapia gênica para DMD (Distrofia Muscular tipo Ducehene) e foi projetada para atingir a causa subjacente da doença.
O SORRYR-1 destaca a crucial importância do MDA (Muscular Dystrophy Association) @mdaorg que esteve presente desde o início nos trabalhos de pesquisas da terapia genética, e criou recentemente uma Rede de Apoio à Terapia Gênica (MDA Gene Therapy Support Network - GTx) para fornecer recursos e orientação para médicos e famílias. O MDA (Muscular Dystrophy Association) é a primeira organização de saúde voluntária nos Estados Unidos voltada para pessoas que vivem com distrofia muscular, e doenças neuromusculares, e que a mais de 70 anos abriu o caminho para acelerar as pesquisas, promoção do atendimento e defesa ao apoio de famílias e indivíduos afetados.
O SORRYR-1 entende esta grande conquista para o tratamento dos portadores de Duchene como uma grande prova dos avanços científicos e empenho da indústria farmacêutica, reforçando assim, a esperança de nós, portadores de doenças relacionadas à mutação no RYR-1, de que uma terapia semelhante possa surgir em um futuro próximo em nosso benefício como tratamento e cura.
TERAPIA GENÉTICA
A terapia genética trata uma doença agindo no próprio gene mutado. A terapia genética pode introduzir um gene para ajudar a combater doenças, substituir um gene mutante, editar um gene mutante ou excluir um gene mutante. Em teoria, as terapias genéticas oferecem o potencial de cura, não apenas de tratamento.
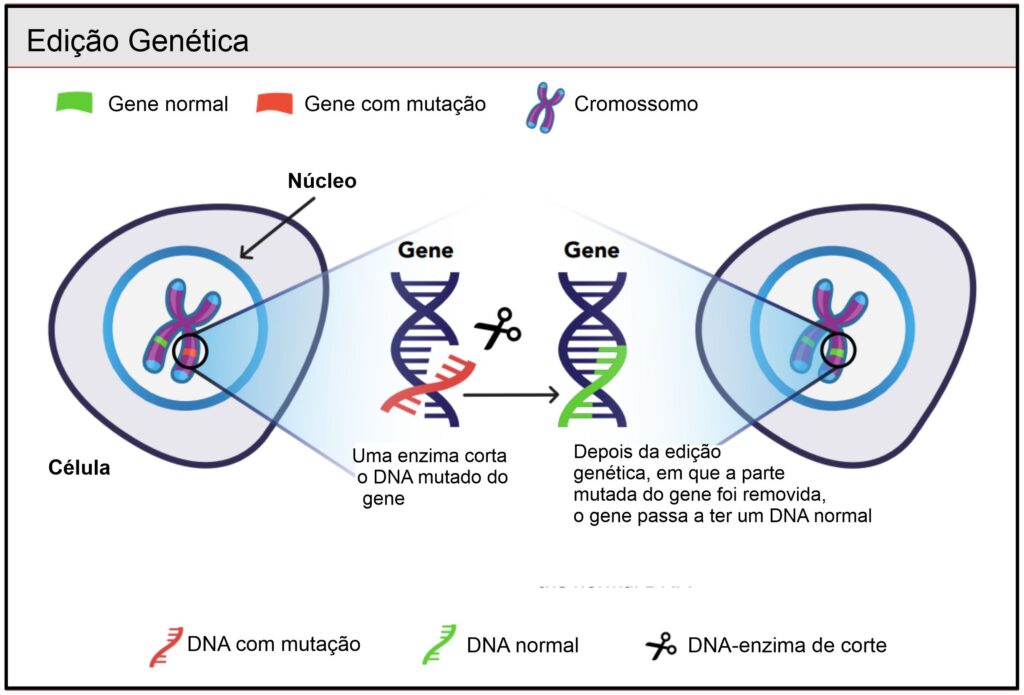
Edição de Gene
Na terapia genética, a edição de genes tem o objetivo de corrigir ou “editar” apenas uma pequena parte do gene, sendo esta, uma abordagem que visa tornar as mudanças mais precisas e permanentes.
RYR-1 Foundation Clinical Care Guidelines
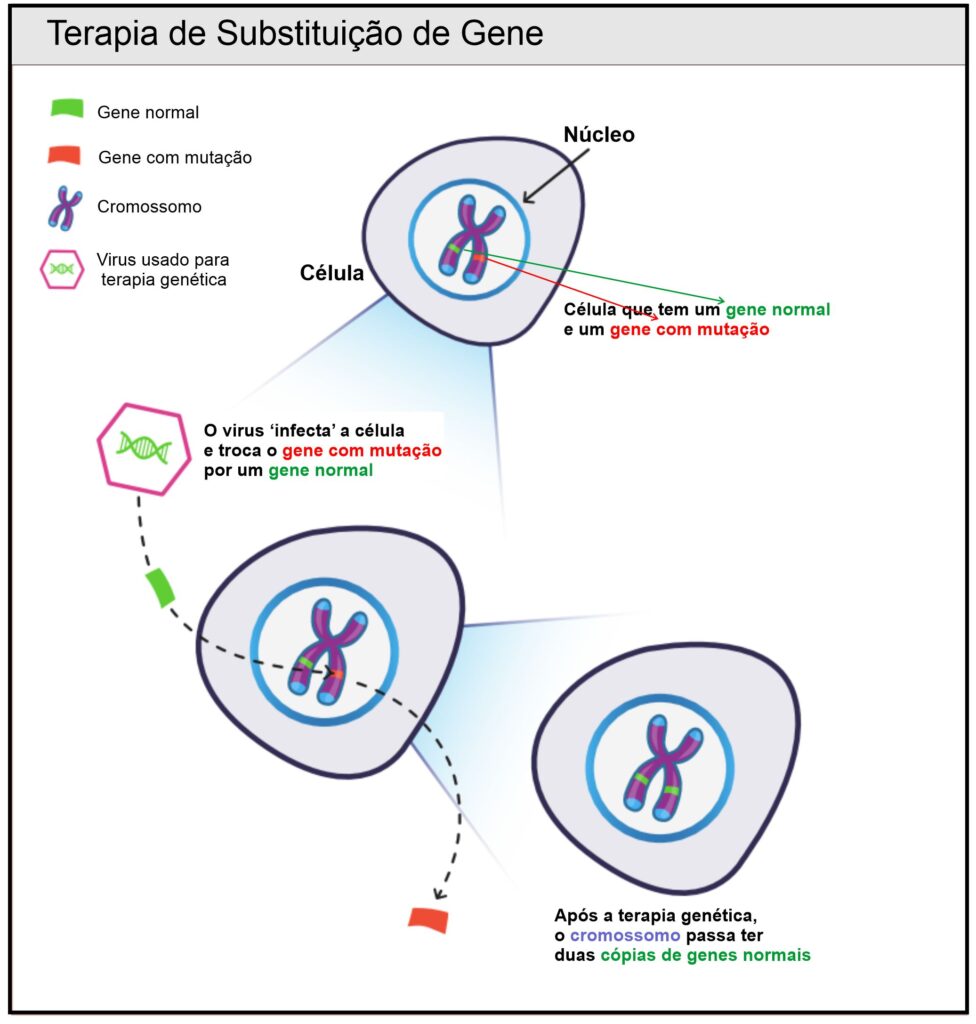
Terapia de Substituição de Gene
A terapia de substituição de gene se dá com a introdução de uma molécula, chamada de vetor, que carrega uma cópia normal de um gene. Os vetores geralmente são vírus, porque podem entrar em uma célula. No entanto, os vírus são projetados para não deixar as pessoas doentes. Alguns vetores comumente usados, chamados Vírus Adenoassociados, levam o gene normal para o núcleo da célula. Ao substituir o gene defeituoso (mutado) por uma nova cópia normal do gene, a célula agora produz uma proteína normal em vez da proteína anormal causadora de doenças.
Atualmente, a terapia de substituição de genes usando um vetor viral padrão não é viável para as doenças relacionadas ao RYR-1, porque o gene RYR1 é muito grande para ser empacotado nos vetores virais comumente usados. A terapia de substituição de genes poderá se tornar uma opção terapêutica no futuro, quando outros vetores paraentrega de genes poderão serem descobertos, ou quando técnicas totalmente novas poderão ser inventadas.
RYR-1 Foundation Clinical Care Guidelines
Lembre-se de que um gene é um segmento de DNA, um código de instruções sobre como produzir proteínas importantes. O DNA é uma molécula de fita dupla muito longa que tem uma forma helicoidal torcida, como uma escada sinuosa. Os blocos de construção do DNA são chamados de nucleotídeos. Existem quatro tipos de nucleotídeos: adenina (A), citosina (C), guanina (G) e timina (T). Uma importante coisa a lembrar é que a sequência de nucleotídeos (A,C,T e G) é a instrução que suas células usam para produzir proteínas. Na maioria dos casos, as doenças genéticas graves são causadas por um único erro ortográfico deste código, por exemplo, você tem um "A" onde deveria haver um "G". Esses erros no código de DNA podem impedir que suas células produzam uma proteína importante ou uma versão ruim disso. O objetivo da edição genética é corrigir permanentemente essas mudanças, alterando a sequência do seu próprio DNA. Pense em levar uma borracha e um lápis para corrigir um erro de ortografia em uma carta manuscrita. Em princípio, isso parece fácil, mas ainda é um grande desafio de fazê-lo de forma correta, eficiente e segura em todas as células.
A maioria das abordagens atuais de edição de genes envolve o uso de proteínas chamadas nucleases as quais cortam o DNA em locais específicos. Em geral, você precisaria de cortar o DNA apenas no local ou próximo ao nucleotídeo incorreto. Pense em colocar a borracha exatamente na palavra que você precisa reescrever. Você não gostaria de cortar DNA em outros lugares, porque isso poderia causar erros perigosos que mudariam o significado do código e fariam com que suas células funcionassem incorretamente.
A mais comumente nuclease usada para edição de genes é o sistema CRISPR/Cas9. Esta técnica é composta por duas partes: Cas9, que é uma proteína que foi descoberta em bactérias, e um RNA Guia. Cas9 e o RNA Guia se unem para formar a nuclease ativa, que você pode imaginar como borracha para a carta manuscrita. Essas tesouras se ligarão ao DNA com base na sequência do RNA Guia. Os cientistas podem alterar a sequência do RNA Guia conforme necessário para cortar quase qualquer sequência de DNA, com algumas limitações. Uma vez que o DNA é cortado, ele será reparado pela célula. Controlar o processo de reparo do DNA determina quais tipos de mudanças podemos fazer ao DNA. Ao contrário da edição precisa em uma carta manuscrita, ainda não temos controle sobre como a sequência será alterada. Alguns tipos de mudanças são fáceis de fazer, enquanto outros são mais difíceis e menos previsíveis.
Além de CRISPR/Cas9 e outras nucleases de edição de genes (por exemplo, dedos de zinco), também existem novas ferramentas promissoras em desenvolvimento. “Editores de base” são versões modificadas do sistema CRISPR/Cas9 que não cortam completamente a molécula de DNA de fita dupla. Em vez disso, eles cortam apenas uma fita, e mudam quimicamente um nucleotídeo para outro dentro de uma determinada janela de edição. Pense como mudar um “l” para um “t” adicionando um traço horizontal a um documento manuscrito. Nenhuma borracha foi necessária, já que esta versão do Cas9 não corta completamente o DNA. Portanto, o risco de falta de palavras é minimizado. A eficácia de editores de base está melhorando e eles têm vantagens significativas para corrigir alterações de nucleotídeo único. No entanto, mais trabalho é necessário para melhorar sua precisão.
A adição mais recente à caixa de ferramentas de edição de genes é o Prime Editing, ou Sistema de Edição Principal. A vantagem de “Prime Editors” é que eles nos deixariam corrigir praticamente qualquer tipo de pequeno erro no DNA, que atualmente não é possível com editores de base. Por exemplo, você pode modificar qualquer letra do alfabeto para qualquer outra, não apenas convertendo “l” para “t” (como no exemplo anterior). No entanto, muito mais trabalho é necessário para demonstrar que eles são seguros, eficazes e confiáveis.
Para resumir, a Edição de Genes é uma tecnologia muito empolgante que só recentemente se tornou possível, principalmente em um ambiente de laboratório de pesquisa. Em contraste com a terapia gênica tradicional, o objetivo é precisamente mudar o DNA do próprio paciente em cada célula do tecido afetado. Isso seria garantir que as mudanças forneçam um conjunto preciso e permanente de instruções de DNA que duraria por toda a vida. Embora esse campo seja uma grande promessa, as ferramentas atuais ainda têm grandes limitações, sendo que um dos maiores é entregar o mecanismo de edição do genoma a intencionada célula alvo do corpo do paciente. Outras considerações incluem o controle de qualquer resposta imune a impedir que o corpo de um paciente ataque as ferramentas de edição de genes. Além disso, maior precisão é necessário para controlar os tipos de alterações a serem feitas no local pretendido (no alvo edição), bem como evitar erros em outras partes do DNA de um paciente (edição fora do alvo). Apesar desses desafios, o futuro da edição de genes é muito brilhante e é algo para se esperar nos próximos anos.
As Doenças Relacionadas ao RYR1 são consideradas como “doenças raras” que afetam os músculos esqueléticos. A mutação no gene RYR-1, responsável pelo desenvolvimento da patologia, tem um impacto significativo na vida das pessoas afetadas e de seus familiares. Além dos sintomas e limitações físicos, como fraqueza muscular, rigidez, dificuldades respiratórias, atrofia muscular, entre outros, a doença tende a afetar seriamente os aspectos psicológicos e emocionais.
Para indivíduos nessa condição, o medo pode se tornar paralisante e afetar a qualidade de vida de diversas maneiras. O medo da morte pode ser comum, visto que a doença não tem cura, e a incerteza sobre a evolução da patologia pode gerar insegurança e ansiedade. Além disso, o medo de como será visto, julgado e excluído pode surgir como consequência da falta de conhecimento e sensibilidade da sociedade em relação às doenças raras.
O medo de atrapalhar as pessoas em função da limitação física ou dependência emocional também pode afetar a qualidade de vida das pessoas portadoras das doenças relacionadas ao RYR1 e seus familiares. Esse medo pode levar ao isolamento social e à falta de participação em atividades cotidianas, o que pode agravar ainda mais os sintomas físicos e emocionais da doença.
Contudo, um dos fatores que merece alerta em relação ao medo é que ele pode afetar negativamente a busca por tratamento, já que a falta de informação e resultados eficazes tende a causar ansiedade e frustração diante de promessas de tratamentos sem resultados efetivos e diretos na causa da doença. O medo pode gerar limitações (barreiras) na adesão ao tratamento, uma vez que a falta de confiança pode levar à desistência ou ao abandono das práticas recomendadas.
É comum também que a pessoa, frente a esse cenário, tenda a desenvolver um mecanismo inconsciente de defesa e comece a se convencer de que não vale a pena aderir ao tratamento, esse é um processo inconsciente para diminuir a dor das constantes frustrações. Então, para não se frustrar ainda mais e evitar decepcionar os familiares, ela sabota o tratamento, no fundo ela teme não conseguir. A falta de conhecimento também pode gerar preconceitos e discriminação por parte da sociedade, o que pode dificultar ainda mais o enfrentamento da doença.
Portanto, é importante trabalhar na conscientização e na superação desses medos, para que o tratamento, mesmo que este tratamento não seja curativo, mas de manutenção, mas seja assim, eficaz e a qualidade de vida seja conquistada. A conversa clara e aberta, como estamos tendo aqui é fundamental para o enfrentamento da realidade. A colaboração de profissionais da psicologia e familiares é fundamental para apoiar a pessoa a lidar com esses medos e com a ansiedade e assim encontrar as melhores soluções para superá-los. Faz sentido para você? E no próximo texto vamos falar sobre a melhor forma de conseguir os resultados psicológicos necessários aqui citados.
O texto acima foi escrito e gentilmente cedido ao SORRYR-1 como colaboração pela Psicóloga Mirella Nery (CRP 09/002785) - @mirellanerypsi
A COMUNIDADE CIENTÍFICA AFIRMA QUE ATIVIDADE FÍSICA É IMPORTANTE PARA PORTADORES DE MIOPATIA COMO FORMA TERAPÉUTICA
Sempre que estamos diante do diagnóstico de uma doença, nossa primeira reação é se informar sobre a existência de tratamento e cura. Trazendo esta situação para realidade das Doenças Relacionadas ao RYR1, não teremos resposta para ambas as questões. Contudo, sabe-se que atualmente os cientistas estão trabalhando ativamente em abordagens potenciais de tratamento e até cura, seja de uma droga a até terapia genética.
A comunidade científica afirma que atividade física é importante para os portadores de miopatia para estimular a força muscular, proporcionar o equilíbrio, promover alongamento, manter em movimento, e buscar sua independência.
Em março de 2012 foi publicado no Journal of Child Neurology a “Declaração de Consenso sobre Padrão de Cuidados para Miopatias Congênitas”, em que se recomenda sob certas circunstâncias e cuidados que se faça exercícios aeróbicos regulares, se possível pelo menos duas ou três vezes por semana.
Sabe-se também que a falta de atividade física para qualquer pessoa causa a perda de força e massa muscular, perda óssea, ganho de peso, compromete o sistema cardio-respiratório, dentre outros, agora imagina esses efeitos danosos para um portador de miopatia.
Por minha experiência de vida como portador de Miopatia Congênita Centronuclear, diria que atividade física não é somente uma forma de promover a manutenção física, mas de tratar a miopatia, pois além de proporcionar o condicionamento e fortalecimento físico, promove a prevenção de eventuais complicações causadas pela doença, podendo inclusive conter seu agravamento.
Como conclusão prática, lembro que o comportamento das pessoas durante o confinamento motivado pela pandemia de COVID-19, fez com que estas de um modo geral se isolassem como forma de distanciamento social, e por conta disso, reclusas em suas casas, reduziram consideravelmente a atividade física, aumentando o comportamento sedentário, e tiveram como resultado o ganho de peso, perda muscular, questões psicoemocionais, dentre outros. Esse comportamento para os portadores de miopatia foi muito mais danoso, porque os indivíduos tiveram que se afastar do que eu diria ser o único tratamento que temos, que é a fisioterapia e outras terapias.
Em março de 2012 foi publicado no Journal of Child Neurology a “Declaração de Consenso sobre Padrão de Cuidados para Miopatias Congênitas”, em que se recomenda sob certas circunstâncias e cuidados que se faça exercícios aeróbicos regulares, se possível pelo menos duas ou três vezes por semana. Em síntese, pode-se verificar a seguir algumas das diretrizes da referida Declaração:
Exercício Físico: Para manter e maximizar a força muscular, aconselhamos o exercício regular de resistência simétrica, idealmente de caráter concêntrico, e a inclusão de atividades recreativas no plano de exercícios. O exercício deve ser para manter a função muscular. Não há evidências de que o exercício seja prejudicial neste grupo de doenças, como alguns acreditam ser o caso das distrofias musculares. Regimes de exercícios de resistência simétricos devem ser feitos regularmente. Embora não haja evidência direta para especificar a frequência ou intensidade do exercício nas miopatias congênitas, o consenso sugere (como em crianças saudáveis) uma frequência mínima recomendada de 2 a 3 vezes por semana. A fadiga induzida pelo exercício e a dor muscular devem ser evitadas. Se estiverem presentes em um determinado nível de atividade, isso deve ser usado como guia para modular a intensidade do exercício. Esportes de alto impacto devem ser evitados devido ao aumento do risco de lesões.
Ficar em pé: A posição em pé é fortemente recomendada mesmo para crianças extremamente fracas e pode ser facilitada através de estruturas em pé, como maca ortostática, estabilizadores verticais, e órteses. O controle das contraturas ou encurtamentos por meio de programas de fisioterapia de alongamento e órteses ajuda manter a capacidade de ficar em pé. Ficar em pé ajuda no controle da contratura e no desenvolvimento do tronco, da pelve e do controle da cabeça. Ficar em pé também serve como precursor da deambulação e ajuda a promover a autoestima. A resistência e o desenvolvimento ósseo podem ser melhorados quando a pessoa fica em pé. É necessário cuidado ao posicionar os pacientes em estruturas em pé (maca ortostática, estabilizadores verticais, e órteses), especialmente para aqueles com contraturas articulares e osteopenia.
Deambulação e mobilidade assistida: A promoção da mobilidade independente é essencial para pacientes com miopatias congênitas, mas isso também pode ser realizada usando deambulação assistida com a utilização de bengala, ou andador. A utilização de cadeira de rodas também deve ser considerada como importante, pois além de promover a independência, desenvolve a força e o equilíbrio pélvico, do tronco e da coluna vertebral.
Amplitude de movimento articular: As recomendações para manter a amplitude de movimento articular incluem alongamento passivo e ativo-assistido, imobilização estática e progressiva. As órteses são usadas para melhorar o controle postural e minimizar a formação de contraturas. As órteses podem ser usadas para maximizar a mobilidade independente e no contexto de um programa de pé estático. A órtese troncular pode ser usada para estabilizar a coluna nas posições sentada ou em pé. E atenção, a toxina botulínica (Botox) é contra-indicada no músculo esquelético para crianças com doença muscular primária para qualquer indicação. O Botox causa paralisia muscular e quando desaparece seus efeitos em 3 a 6 meses, a atrofia por desuso no músculo pode sobrepor à doença muscular primária, e com o atraso na reabilitação pode fazer com que o paciente tenha mais dificuldade na mobilidade.
OS PORTADORES DE DOENÇAS RELACIONADAS AO RYR-1 E SEUS FAMILIARES NÃO ESTÃO SÓS E SUAS CAMINHADAS
No ano de 2018, enquanto participava como convidado de uma pesquisa conduzida pelo Dr. Carsten Bonnemann, no NIH - National Institutes of Health, em Bethesda, MD, E.U.A., em meio a tantas informações que estava obtendo, tive a grata satisfação de tomar conhecimento da existência da Fundação RYR-1, sediada em Pittsburgh, PA. Ansioso e eufórico com tudo que estava vivendo naqueles dias, no momento imediato fiz contato com a organização para conhecer e saber mais sobre seus propósitos, e o resumo de tudo aquilo se traduziu em um grande marco na minha vida, pois descobri depois de muito tempo que eu não vivia solitário uma doença desconhecida, e sem ninguém se importar com o que sentia, e o quê poderia ser feito sobre tudo aquilo.
Assim, é com muito respeito e gratidão que gostaria de apresentar a Fundação RYR-1. A Fundação RYR-1 foi iniciada por membros da Família Goldberg, que foram afetados por uma doença relacionada ao RYR-1. Atualmente, não há nenhuma outra organização que exista apenas para defender e atender às necessidades dos pacientes com doenças relacionadas ao RYR-1. O objetivo da Fundação é preencher esse vazio tão necessário.

A missão da Fundação RYR-1 é apoiar pesquisas que conduzam a um tratamento eficaz ou cura para doenças relacionadas ao RYR-1.
Para cumprir esta missão, a Fundação tem vários objetivos:
A Fundação RYR-1 é liderada por uma equipe dedicada de indivíduos. Isso inclui o Conselho de Administração, o Conselho Consultivo Científico, e o Conselho de Consultores, e as operações diárias são lideradas pelo Diretor do Programa.
Contudo, ao conhecer a Fundação RYR-1, o que mais me impressionou com esta organização foi, acima das questões científicas, pela personalidade que seus trabalhos são conduzidos, e tudo isso tendo à sua frente o Dr Michael F. Goldberg, MD, MPH, que também é portador de uma miopatia relacionada ao RYR-1, o que lhe confere uma grande propriedade por entender todas as questões ligadas à doença, e assim gerir a organização. Gostaria de compartilhar uma mensagem escrita pelo Dr Michael, transcrita do site da fundação (@RYR1.org):
“Embora raras, as doenças relacionadas ao RYR-1 são a forma mais comum de “miopatia congênita” - doença muscular causada por uma mutação genética. As manifestações mais comuns incluem: fraqueza muscular leve a moderada (por exemplo, dificuldade em subir escadas), fraqueza grave (por exemplo, necessidade de assistência de cadeira de rodas e suporte respiratório), cãibras e dores musculares e uma reação potencialmente fatal à anestesia, chamada hipertermia maligna. No entanto, apesar da prevalência desta doença e da gravidade desses sintomas, a Fundação RYR-1 é a única organização que existe apenas para apoiar a pesquisa sobre esta doença. Além disso, a Fundação RYR-1 atende às necessidades e defende indivíduos e famílias afetadas por doenças relacionadas ao RYR-1.
Em um período muito curto de tempo, a Fundação RYR-1 tornou-se líder no campo de doenças relacionadas ao RYR-1.
Devido ao apoio de nossos muitos benfeitores generosos, o trabalho da Fundação levou a avanços importantes no conhecimento científico. Além disso, formamos uma comunidade mundial de indivíduos afetados que podem encontrar conforto e apoio sabendo que não estão sozinhos e que agora nossa organização existe para ajudá-los.
A necessidade de tratamentos ou cura é urgente. Com o seu apoio, a Fundação RYR-1 pode continuar a financiar cientistas de renome mundial, expandir a comunidade RYR-1 e tornar nosso slogan, “Strength in Numbers,” (“Força em Números”), uma realidade.”
- texto/mensagem transcrita da brochura promocional da Fundação RYR-1 -
Conheça e tenha maiores informações sobre a Fundação RYR-1 através do link : https://www.ryr1.org/
DOENÇAS RELACIONADAS AO RYR-1 É UM TERMO “GUARDA-CHUVA”, OU SEJA, QUE ABRANGE ALGUMAS DIFERENTES DOENÇAS MUSCULARES
As doenças relacionadas ao RYR1 são raras, e classificadas como doenças órfãs , “órfãs”, se trata de um termo usado para identificar uma doença que afeta uma pequena percentagem da população. A verdadeira prevalência dessas doenças é difícil de calcular, pois muitos casos são mal diagnosticados ou não diagnosticados. Também há relatos de prevalência ligeiramente aumentada em certas populações étnicas e geográficas.
As doenças relacionadas ao RYR1 são devidas a uma mutação ou mutações no gene RYR-1. Na prática, podemos sintetizar o processo de mutação da seguinte maneira: o gene RYR-1 codifica o receptor RYR-1, o qual é um canal de cálcio no retículo sarcoplasmático do músculo esquelético; o fluxo de cálcio através do receptor RYR-1 é um componente crítico para a excitação-contração muscular. Uma mutação no gene RYR-1 pode alterar o número, estrutura e/ou função do receptor RYR-1, podendo assim desencadear uma ampla gama de sintomas, e consequências clínicas diferentes, que podemos chamar de doenças relacionadas ao RYR1.
As doenças relacionadas a RYR-1 (RYR1-RD) receberam, seus nomes com base na classificação histopatológica, ou seja, pela forma que músculo apareceu na biópsia sob um microscópio (por exemplo, Miopatia Central Core, Doença Multi-Minicore, Miopatia Centronuclear, e Desproporção Congênit26a do Tipo de Fibra). Além disso, muitos casos de Hipertermia Maligna (HM) ocorrem devido a uma mutação no gene RYR1. Esses vários termos têm sido uma fonte de confusão para pacientes e médicos. É fundamental lembrar que, independentemente da aparência microscópica da biópsia muscular, são necessários testes genéticos para confirmar o diagnóstico de doenças relacionadas ao RYR-1.
Doenças Relacionadas a RYR-1 (RYR-1-RD) é um termo “guarda-chuva” que abrange doenças musculares que ocorrem como resultado de mutações no gene RYR1. Estes incluem condições que historicamente receberam seus nomes com base na classificação histopatológica, ou seja, como a biópsia muscular apareceu sob um microscópio (por exemplo, doença do núcleo central, doença de múltiplos minicores, miopatia centronuclear e desproporção do tipo de fibra congênita. hipertermia maligna (HM) é devido a uma mutação no gene RYR1.
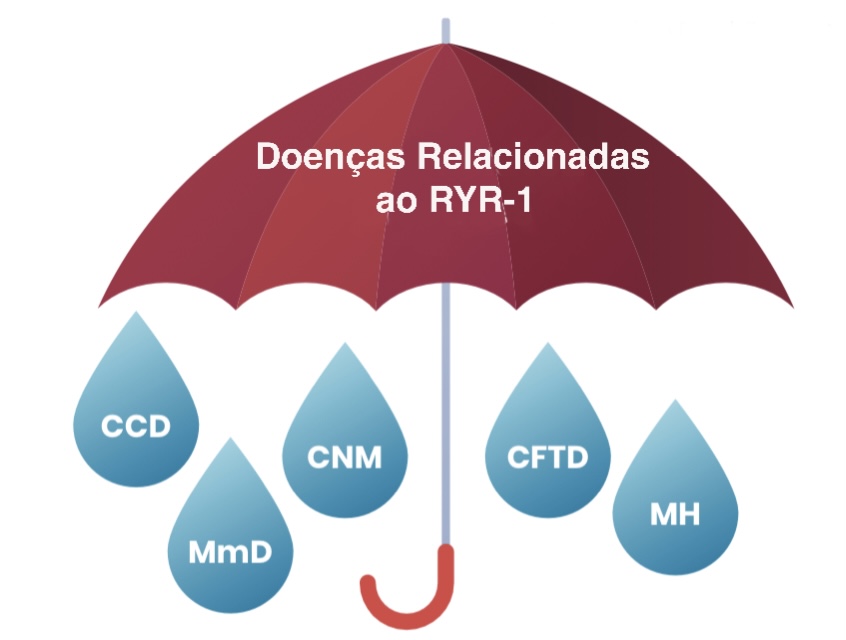
Miopatia Central Core - Central Core Disease (CCD)
Verifique os tipos de Doenças Relacionadas ao RYR1 a seguir...
Miopatia Central Core - Central Core Disease (CCD)
Miopatia Central Core (CCD) é o termo usado pelos patologistas para descrever o tecido de biópsia muscular desprovido de uma mancha específica no meio de uma fibra muscular, dando a aparência de "núcleo". A CCD causa uma fraqueza muscular que varia de quase assintomática a muito grave. A maioria das pessoas com CCD experimentam fraqueza muscular leve e persistente que pode piorar com o tempo. Essa fraqueza afeta os músculos próximos ao centro do corpo (músculos proximais), particularmente os músculos das coxas e quadris. A fraqueza muscular também pode fazer com que os bebês afetados pareçam "moles" e pode atrasar o desenvolvimento de suas habilidades motoras, como sentar, levantar e andar. Em casos graves, os bebês afetados apresentam tônus muscular profundamente fraco (hipotonia), resultando em dificuldades de alimentação e problemas respiratórios graves ou com risco de vida. O CCD também está associado a anormalidades esqueléticas, como curvatura anormal da coluna vertebral (escoliose), luxação do quadril e deformidades articulares chamadas contraturas que restringem o movimento de certas articulações. Indivíduos com CCD tendem a permanecer ambulatoriais durante toda a vida.
Doença Multi-Minicore (MmD)
A Doença Multi-minicore (MmD) é uma doença que clinicamente causa fraqueza muscular e problemas de saúde relacionados, que variam de leves a fatais. Os pesquisadores identificaram pelo menos quatro formas de MmD, que podem ser distinguidas por seus sinais e sintomas característicos. A forma mais comum, chamada de forma clássica, causa fraqueza muscular começando na primeira infância. Essa fraqueza é mais perceptível nos músculos do tronco e pescoço (músculos axiais), e é menos grave nos músculos dos braços e pernas. A fraqueza muscular faz com que os bebês afetados pareçam "moles" (hipotônicos) e podem atrasar o desenvolvimento de habilidades motoras, como sentar, ficar em pé e andar. A doença faz com que os músculos da parede torácica e da coluna endureçam. Quando combinada com a fraqueza dos músculos necessários para respirar, essa rigidez leva a problemas respiratórios graves ou com risco de vida. Quase todas as crianças com MmD desenvolvem uma curvatura anormal da coluna vertebral (escoliose), que aparece durante a infância e piora constantemente ao longo do tempo. Deve-se notar que certos indivíduos com MmD têm mutações no gene RYR-1, enquanto outros indivíduos têm mutações em outros genes (por exemplo, SEPN1).
Miopatia Congênita Centronuclear - Centronuclear Myopathy (CNM)
A Miopatia Congênita Centronuclear (CNM), tem sido associada a várias condições genéticas diferentes, incluindo mutações no RYR-1. Indivíduos com CNM geralmente começam a sentir fraqueza muscular a qualquer momento, desde o nascimento até o início da idade adulta. Muitos dos sintomas da CNM coincidem com os da Central Core (CCD). A fraqueza muscular causada pela CNM pode levar ao atraso no desenvolvimento de habilidades motoras (engatinhar ou andar) e pode ser lentamente progressiva. Algumas pessoas afetadas podem precisar de assistência em cadeira de rodas. Outros sintomas incluem: problemas respiratórios leves a graves, ptose (queda da pálpebra superior), fraqueza nos músculos faciais, anormalidades nos pés, um arco alto no céu da boca (palato arqueado) e escoliose.
Desproporção Congênita do Tipo de Fibra - Congenital Fiber - Type Disproportion (CFTD)
Indivíduos com a doença da Desproporção Congênita do Tipo de Fibra (CFTD), geralmente experimentam fraqueza muscular, principalmente nos músculos dos ombros, braços, quadris e coxas. A fraqueza também pode afetar os músculos da face, músculos que controlam os movimentos oculares (oftalmoplegia) e músculos da pálpebra superior (ptose). Os indivíduos com CFTD geralmente têm uma face longa, um arco alto no céu da boca (palato arqueado alto) e dentes apinhados. Os indivíduos afetados podem ter deformidades articulares (contraturas) e uma região lombar anormalmente curvada (lordose) ou uma coluna que se curva para o lado (escoliose). Aproximadamente 30% das pessoas com esse distúrbio apresentam problemas respiratórios leves a graves relacionados à fraqueza dos músculos necessários para respirar. Algumas pessoas que experimentam esses problemas respiratórios precisam do uso de uma máquina para ajudar a regular a respiração à noite e, ocasionalmente, durante o dia. Cerca de 30% dos indivíduos afetados têm dificuldade em engolir devido à fraqueza muscular na garganta. Raramente, as pessoas com essa condição têm um músculo cardíaco enfraquecido e aumentado (cardiomiopatia dilatada).
Suscetibilidade a Hipertermia Maligna - Malignant Hyperthermia Susceptibility (MH)
Indivíduos sensíveis à Hipertermia Maligna (MH) podem experimentar uma vida diária normal sem qualquer sintoma ou fraqueza muscular. No entanto, quando expostos a certos agentes anestésicos, os pacientes podem experimentar um episódio de Hipertermia Maligna. A Hipertermia Maligna caracteriza-se por um estado hipermetabólico, causando um aumento anormal do calor, com rigidez excessiva e quebra muscular associada, e aumento da frequência cardíaca. As complicações graves da HM incluem: lesão cerebral, sangramento interno, parada cardíaca e/ou falência de múltiplos órgãos. As complicações cardiovasculares associadas podem ser fatais. Qualquer indivíduo com uma mutação(ões) do RYR-1, se a anestesia for necessária para um procedimento médico-cirúrgico, é aconselhado a tomar "precauções contra hipertermia maligna". Indivíduos com mutações RYR-1 suscetíveis a MH também correm risco de rabdomiólise, bem como outras dores e cãibras musculares relacionadas ao calor e ao esforço. Rabdomiólise é o termo geral para ruptura muscular associada a uma ampla variedade de gatilhos externos, incluindo: exercícios extenuantes além do limite de fadiga, abuso de drogas ou álcool, uso de suplementos ou certos medicamentos, doença viral recente ou trauma muscular. Os sinais e sintomas da rabdomiólise incluem dor muscular intensa, elevação repentina e queda subseqüente dos níveis séricos de creatina fosfoquinase (CPK) e produtos da quebra muscular na urina ("mioglobinúria"). O curso da rabdomiólise é caracterizado principalmente por mialgia (dor muscular) com aumentos leves a moderados da CPK. Nesses casos leves, muitos indivíduos não procuram atendimento médico. No entanto, em alguns o curso clínico é grave, resultando em hiper-CK-emia profunda, insuficiência renal aguda, síndrome do compartimento, coagulação intravascular disseminada, arritmias cardíacas secundárias a desequilíbrios eletrolíticos e, possivelmente, parada cardíaca se não tratada. Portanto, indivíduos com mutações no RYR-1, especialmente aquelas conhecidas por estarem associadas à suscetibilidade ao HM, devem estar cientes dos gatilhos da rabdomiólise e podem querer consultar um médico antes do início de um regime de exercícios e/ou esportes. Pode haver um papel do dantroleno como agente profilático na prevenção da rabdomiólise e de outros sintomas musculares relacionados ao esforço e ao calor.

No caso específico do gene RYR1, a mutação ou mutações podem causar disfunções, denominadas também como Doenças Relacionadas ao RYR1. As mutações no gene RYR1 podem resultar em: 1). Uma proteína RYR1 que não funciona corretamente; e/ou, 2). Uma redução na quantidade de proteína RYR1 que é produzida pela célula muscular. Cientistas que estudam a matéria já encontraram mais de 200 mutações no RYR1 que causam Doenças Relacionadas ao RYR1.
As doenças relacionadas ao RYR1 são raras e classificadas como doenças orfãs, termo este utilizado por ser uma doença que afeta uma pequena porcentagem da população. A verdadeira prevalência dessa doença é difícil de calcular, pois muitos casos são mal diagnosticados, ou mesmo não diagnosticados. Existem relatos de prevalência ligeiramente aumentada em certas populações étinicas e geográficas.
Existem vários tipos de Doenças Relacionadas ao RYR1, e estas têm sido historicamente caracterizadas pela aparência da célula muscular retirada por uma biópsia muscular. No entanto, é importante lembrar que a maneira mais definitiva de fazer um diagnóstico de uma Doença Relacionada ao RYR1 é por meio de testes genéticos.
Fonte da Figura: blog.varsomics.com
• tipo de mutação(ões) encontrada no gene RYR1;
• localização específica da(s) mutação(ões) no gene RYR1;
• efeito específico da mudança do gene na estrutura, função e/ou quantidade de proteína do RYR1.