Foi através do RYR1 Foundation que tive a grande honra e prazer em ter conhecido a Dra Isabelle Marty, PhD, uma cientista que trabalha no INSERM, French National Institute for Medical Reserach. Ela gerencia o C-MyPath (Cellular Myology and Pathology), um centro de pesquisas focado nas doenças neuromusculares, coordenando uma equipe de cientistas, geneticistas, e médicos do Grenoble Institute of Neuroscience na França. Durante meu encontro com a Dra Isabelle, externei a ela sobre nossa ansia como portadores da Miopatia Congênita Centronuclear, uma doença relacionada ao gene RYR1, sobre o aparecimento da cura ou mesmo de um tratamento para a doença, e como contribuição ao SORRYR-1, ela gentilmente enviou um artigo relatando o que está acontecendo nas bancadas de laboratórios de grandes centros de pesquisas científicas ao redor do mundo. O texto reforça meu entendimento de que SER OTIMISTA COM NOSSO FUTURO, É TER FÉ EM DEUS, E ACREDITAR NA CIÊNCIA TRABALHANDO EM NOSSO BENEFICIO.
Segue o texto (tradução por Orlando Carneiro Jr)…
DESENVOLVIMENTO TERAPÊUTICO EM PROGRESSO PARA MIOPATIAS RELACIONADAS AO RYR1
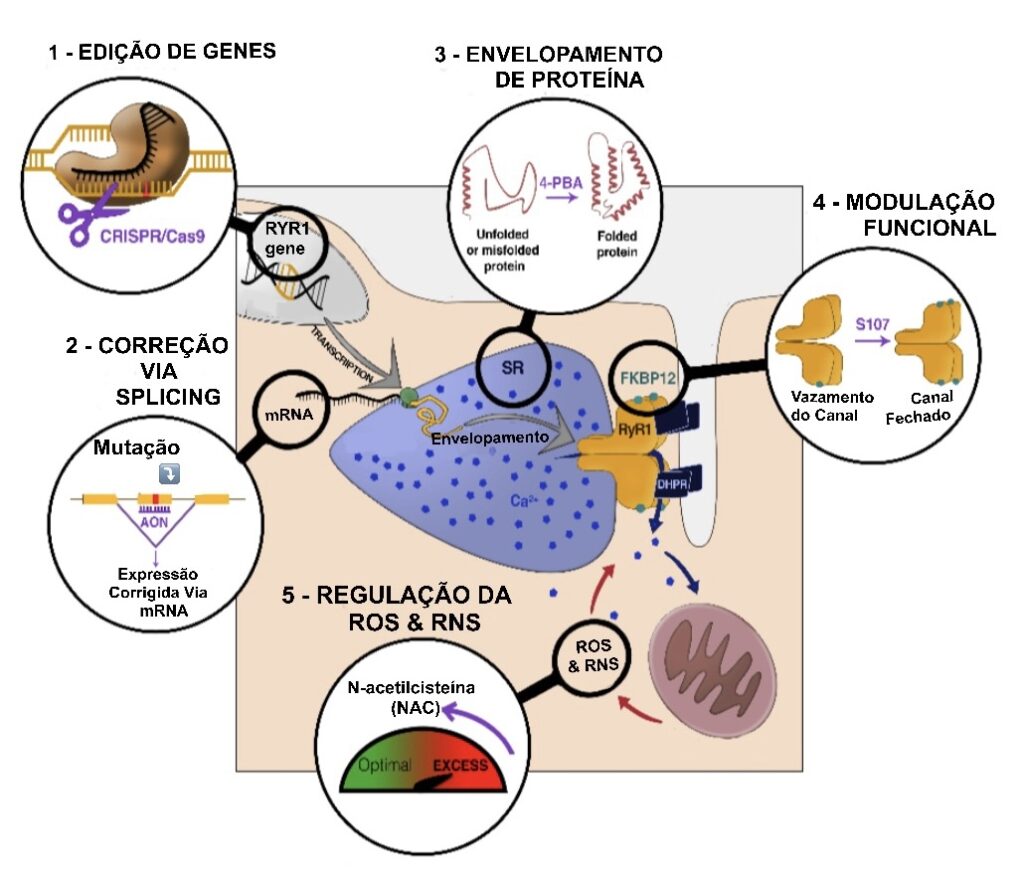
Ainda não existe nenhum tratamento para as miopatias relacionadas ao gene RYR1, em parte devido ao número de mutações, mas também pela diversidade de suas consequências. Um pré-requisito para o desenvolvimento terapêutico para a doença é a disponibilidade de modelos de pesquisa (cobaias) que reproduzam as características da doença, assim como ter uma boa compreensão dos mecanismos fisiopatológicos (funcionamento da doença). Contudo, esses dois aspectos estão em rápida evolução, pois muitos modelos celulares ou animais (cobaias) foram desenvolvidos recentemente, e diferentes abordagens estão sendo avaliadas, seja em pesquisas básicas, em estudos pré-clínicos, ou mesmo em ensaios clínicos (clinical trials). Estes estudos podem ser classificados como “estratégias gerais”, tendo como alvo o mecanismo fisiopatológico normalmente verificado em diferentes mutações/pacientes, tais como moléculas químicas, ou “estratégia orientada personalizada ao paciente”, tendo alvo a mutação específica de cada paciente, como exemplo a terapia gênica.
As abordagens farmacológicas visam testar moléculas que interagem com gene RYR1 ou com suas proteínas associadas, visando sempre na busca de melhorar a função do canal ou as vias fisiológicas do RYR1. Por outro lado, a terapia gênica foca diretamente o gene mutado ou via mRNA para corrigir a própria proteína do RYR1, restaurando assim a expressão funcional da proteína. Em ambas as abordagens, o objetivo é restaurar a homeostase normal do cálcio e, posteriormente, a força muscular.
ABORDAGENS FARMACOLÓGICAS
O uso de compostos químicos para corrigir as alterações funcionais do gene RYR1 baseia-se na decifração precisa dos mecanismos fisiopatológicos e na identificação de moléculas que atuam no mecanismo alvo, geralmente capazes de restaurar a homeostase do cálcio. Esses compostos podem atuar diretamente no RYR1, alterando suas propriedades, conformação e/ou interação com proteínas reguladoras, a fim de restaurar o fluxo normal de cálcio, mas também de agir nas consequências causadas pela alteração do curso do fluxo de cálcio. Cada mutação pode resultar em diferentes mecanismos fisiopatológicos, por isso é importante identificar diferentes famílias de moléculas, para os diferentes mecanismos. Outro aspecto importante é o uso prévio ou já utilização de compostos químicos para humanos, o que poderia reduzir drasticamente o atraso entre a prova de conceito da eficácia e seu lançamento à comercialização.
Em se tratando de estudo dos mecanismos fisiopatológicos, a primeira alteração celular identificada é um elevado estresse oxidativo, observado em muitos modelos portadores de miopatias relacionadas ao RYR1, de zebrafish a camundongos, e em cultura muscular primária em pacientes. Seguindo essa linha, foi testado com sucesso nesses diferentes modelos, o tratamento com o antioxidante N-Acetilcisteína (NAC) resultando na melhora de suas características moleculares e fisiológicas. Esses resultados encorajadores observados nos referidos modelos, levaram pesquisadores a promover ensaios clínicos a fim de testar a eficácia do NAC para diminuir o elevado estresse oxidativo, assim como aumentar a resistência física em pacientes com miopatias relacionadas ao RYR1. Esse estudo com NAC confirmou o aumento do estresse oxidativo nos pacientes portadores de doenças relacionadas ao RYR1, mas o tratamento não foi capaz de corrigir esse aumento em comparação ao grupo placebo. Do ponto de vista funcional, o resultado embora tenha sido medido um ligeiro aumento na distância percorrida (6MWT - six minute walk test ), não atingiu valores com significância.
O segundo mecanismo alterado com algumas mutações é a interação do RYR1 com sua proteína de ligação, ou proteína reguladora FKBP12 (também chamada calstabina), a qual visa manter o canal de cálcio do RYR1 eficientemente fechado. A consequência dessa alteração é um vazamento do cálcio contido nas reservas de cálcio do músculo, fazendo com que a estimulação do músculo não levará a uma liberação de cálcio suficiente para produzir uma contração normal. Pesquisadores identificaram moléculas denominadas RyCals, capazes de reduzir esse vazamento de cálcio, trazendo assim a abordagens terapêuticas promissoras. Testes clínicos foram lançados pela ARMGO Pharma Inc, em um número restrito de pacientes que apresentaram um “RYR1 com vazamento" confirmado, fornecendo resultados encorajadores sobre tolerância e dor muscular. O benefício agora deve ser confirmado no nível de força muscular em um grupo maior de pacientes.
As proteínas são classes de macromoléculas biológicas de maior importância no metabolismo celular e na fisiologia dos organismos, e alguns mecanismos celular naturais, como o enovelamento de proteínas (protein folding), também mostraram ser alterados, o que faz com que a célula não desempenhe sua função correta, e o tratamento de alguns modelos de camundongos com 4-fenilbutirato de sódio (4-PBA), droga que melhora o enovelamento de proteínas, mostrou algum benefício no animal, mas ainda não foi testado em humanos.
Muitas equipes de pesquisadores ao redor do mundo estão trabalhando para identificar moléculas que possam melhorar a liberação de cálcio muscular, seja no reposicionamento de moléculas usadas para outras condições (drogas já utilizadas para outras doenças), ou para identificar novas moléculas que nunca foram testadas em animais ou humanos (nova droga).
TERAPIA DE GENES
Uma vez identificada a mutação responsável por uma doença, o objetivo das abordagens de terapia gênica é modificar o genoma das células do indivíduo afetado para corrigir essa mutação e restaurar de forma sustentável a função alterada caracterizada na patologia. Uma questão importante para as doenças neuromusculares é a capacidade de atingir todos os músculos do corpo e especialmente os músculos respiratórios (diafragma e músculos intercostais) que estão entre os menos acessíveis à injeção. Existem várias maneiras de desenvolver uma estratégia gênica, dependendo da mutação alvo, sua localização na sequência de DNA, e suas consequências na função proteica.
- Reposição de genes
A substituição gênica, é a introdução de uma cópia nova e funcional de um gene alterado através de um vetor viral, estratégia considerada interessante para as mutações de perda de função. O uso de um vetor viral como o Vírus Adeno-Associado (AAV) permite com uma única injeção intravenosa, atingir todos os músculos do corpo, mesmo os músculos respiratórios e diafragma menos acessíveis. Um resultado espetacular da terapia genética foi obtido para Atrofia Muscular Espinhal (AME). Esta promissora abordagem terapêutica tem, infelizmente, algumas limitações, relacionadas com a capacidade de empacotamento do vetor viral utilizado. Atualmente, não é possível integrar a sequência de codificação do RYR1, que é muito grande, nem é possível integrar uma versão truncada mais curta e funcional do RYR1.
- Terapias no nível de mRNA
Quando a correção no gene é muito complexa, como por exemplo nos genes grandes, uma estratégia alternativa é direcionar o mRNA, chamado de RNA mensageiro, que funciona carregando a informação entre o gene e a proteína. A correção do RYR1 via mRNA é especificamente adequada para um subgrupo de mutações, no caso, as mutações que resultam na presença de um segmento adicional na proteína (o chamado "exon"), para o qual a estratégia "exon skipping" que não modifica o gene que possui a mutação, mas ele interfere e modifica o processo de transferência da informação genética e, portanto, as instruções ou mecanismos de funcionamento do RYR1. Esta abordagem tem mostrado resultados extremamente encorajadores e está em desenvolvimento clínico para algumas doenças neuromusculares entre as quais Distrofia Muscular de Duchenne (DMD) e Atrofia Muscular Espinhal (SMA - Spinal Muscular Atrophy).
- Edição de genes
Um novo campo de trabalho surgiu recentemente e está crescendo exponencialmente, que é a correção gênica por CRISPR/Cas9. A base deste sistema de edição de genes, também chamado de “tesoura molecular”, é separar o DNA em um local muito específico e escolhido, a fim de deletar uma parte do DNA (por exemplo a que contém a mutação) e assim substituí-la por um novo DNA ( sem a mutação). Até agora, para doenças musculares em modelos animais, só era possível deletar um segmento de DNA mutado, mas não substituí-lo. Mas o avanço tecnológico está evoluindo em uma velocidade impressionante e novas ferramentas de edição de genes estão sendo desenvolvidas, capazes teoricamente de corrigir qualquer mutação, pelo menos em modelos celulares, como por exemplo o Prime-editing, ferramenta mais complexa que a edição CRISPR/Cas9, porque ela pode excluir comprimentos longos de DNA causador de doença ou mesmo inserir DNA para reparar mutações.
A terapia gênica é um novo desafio para doenças genéticas, a qual era apenas um sonho há 20 ou 30 anos atrás. Apesar de todos os desafios que a abordagem de edição genética está enfrentando, soluções devem ser encontradas antes de passar para um tratamento real em humanos, além de uma série de questões éticas que foram levantadas por esta nova tecnologia, a terapia gênica e edição de genoma parecem ter o maior potencial terapêutico a longo prazo.
 CONCLUSÃO
CONCLUSÃO
Embora nenhum tratamento esteja disponível para as doenças relacionadas ao RYR1, as vias terapêuticas estão sendo exploradas ativamente. Da terapia farmacológica mais antiga, usada há muito tempo, com efeitos colaterais conhecidos e benefícios mais ou menos modestos, à mais nova terapia genética com efeitos colaterais desconhecidos e enormes benefícios potenciais esperados, a terapia intermediária perfeita ainda precisa ser descoberta. Ou seja, uma combinação de diferentes abordagens pode ser uma boa alternativa, como um composto químico capaz de reduzir a quantidade de vetor viral necessária para terapia gênica, melhorando a entrada no músculo, ou melhorando a estrutura muscular. Embora os sucessos recentes em diferentes doenças neuromusculares provavelmente tenham gerado novas esperanças, a pesquisa ativa deve continuar nas duas direções, pois ainda é difícil prever hoje qual será o futuro das terapias para as doenças relacionadas ao RYR1, sendo as terapias de curto e longo prazo provavelmente a milhas de distância.