A grande maioria das pessoas a partir dos 50 anos se deparam com complicações ortopédicas, seja nas articulações, coluna, quadril, dentre outros, e isso geralmente se deve pelo uso inadequado do corpo gerando os desgastes naturais que acontecem no decorrer da vida, ou acontece também pela falta de exercícios físicos.
No caso do indivíduo portador de miopatia centronuclear, doença essa causada pela mutação no gene RYR-1, responsável pelo funcionamento dos músculos, as implicações ortopédicas em relação a uma pessoa sem a doença, é potencializada, e pode levar a uma série de complicações já desde o nascimento. Como já explicado em postagens anteriores, cada pessoa com doença relacionada ao RYR-1 é única, assim como a evolução da doença, as complicações também podem afetar diferentemente cada indivíduo.
Nesta postagem, vou discorrer sobre alguns dos principais problemas ortopédicos com os quais pessoalmente convivo, e que podem ocorrer com os indivíduos afetados por uma doença relacionada ao RYR-1, que são:
 nas articulações e tendões. No nosso caso, portadores de miopatia, a situação é logicamente agravada, porque como nossos músculos não são utilizados adequadamente, o enfraquecimento muscular é aumentado, resultando em instabilidade nas articulações, e isso pode aumentar o risco de lesões, como distensões ou rupturas de tendões. Além disso, a imobilidade por fraqueza muscular pode levar à rigidez articular e à perda de amplitude de movimento, o que pode causar dor e desconforto. Essa falta de mobilidade muscular também pode contribuir para o desenvolvimento de condições como a artrite, pois as articulações não recebem o movimento necessário para manter a saúde e a lubrificação adequada.
nas articulações e tendões. No nosso caso, portadores de miopatia, a situação é logicamente agravada, porque como nossos músculos não são utilizados adequadamente, o enfraquecimento muscular é aumentado, resultando em instabilidade nas articulações, e isso pode aumentar o risco de lesões, como distensões ou rupturas de tendões. Além disso, a imobilidade por fraqueza muscular pode levar à rigidez articular e à perda de amplitude de movimento, o que pode causar dor e desconforto. Essa falta de mobilidade muscular também pode contribuir para o desenvolvimento de condições como a artrite, pois as articulações não recebem o movimento necessário para manter a saúde e a lubrificação adequada.
Para concluir, eu diria que as complicações ortopédicas acima descritas podem ser inevitáveis aos portadores de miopatias relacionadas ao RYR1, sejam elas por origem congênita, ou em decorrência das adaptações que o indivíduo precisa fazer para conseguir movimentar durante a vida, ou pelas que acontecem com o desgaste natural do envelhecimento. Como portador de Miopatia Congênita Centronuclear, eu convivo com todas as complicações descritas, e de todas as origens de causas. Contudo, vejo que existem formas de se prevenir, postergar o seu surgimento ou agravamento, e até de se mitigar os sintomas das complicações ortopédicas. A educação postural, e o desenvolvimento pessoal de consciência corporal, devem fazer parte do nosso dia a dia. No caso de as complicações já terem se instaladas, o manejo desses problemas geralmente envolve uma combinação de fisioterapia, alongamentos, terapia ocupacional e, em alguns casos as intervenções cirúrgicas para corrigir deformidades ou melhorar a função do corpo. Por fim, é fundamental que os portadores de miopatia centronuclear sejam acompanhados por uma equipe multidisciplinar para abordar essas questões de forma abrangente, preventiva e terapêutica.
Em julho de 2022, a Fundação RYR1 promoveu o Workshop Internacional de Pesquisa sobre Doenças Relacionadas ao RYR-1: Dos Mecanismos aos Tratamentos, foi o primeiro workshop internacional de pesquisa dedicado exclusivamente às doenças relacionadas ao RYR1 . O evento reuniu 45 pesquisadores presenciais e 10 virtuais de 11 países diferentes, todos envolvidos em pesquisas na busca de tratamento das doenças relacionadas ao RYR1, RYR1-RD (veja a galeria de imagens do evento). Sob a coordenação da co-diretora Brentney Simon, fui convidado, juntamente com um time de 10 indivíduos afetados por RYR1-RD para compartilhar nossa vivência, conhecimentos e interagir com os presentes. O objetivo científico do workshop foi promover um fórum que unisse os principais especialistas internacionais em doenças RYR1 (pesquisadores, clínicos e geneticistas) com indivíduos afetados, familiares e defensores de pacientes para compartilhar conhecimento, trocar ideias, formar colaborações e desenvolver novas estratégias para encontrar terapias eficazes.
Além do mais, nosso time desenvolveu e conduziu uma pesquisa com aplicação on-line, dirigida a 227 indivíduos, permitindo que pessoas afetadas por RYR1-RD tivessem suas vozes ouvidas através dos dados coletados. Nossos esforços foram tão bem-sucedidos que a Dra. Nicol C Voermans (Department of Neurology, Radboud University Medical Center, The Netherlands - click aqui e conheça seu histórico), uma das cientistas presentes, convidou Brentney para colaborar com sua equipe para compartilhar esses insights com profissionais médicos, além da comunidade RYR-1, na forma de um Artigo de Pesquisa.
Estou muito orgulhoso de ter feito parte deste importante projeto, dado sua importância médico-científica, à medida que o mesmo poderá contribuir nos avanços em busca de tratamento para as doenças relacionadas ao RYR1 (RYR1-RD).
Confira a seguir a publicação original (click no link ) ⇒ https://pubmed.ncbi.nlm.nih.gov/39150833
....ou a publicação original em pdf ⇒ https://content.iospress.com/download/journal-of-neuromuscular-diseases/jnd240029?id=journal-of-neuromuscular-diseases%2Fjnd240029
.... ou confira a seguir nesta postagem, a tradução e adaptação para a lingua portuguesa da publicação entitulada "INDIVÍDUOS E FAMÍLIAS AFETADAS POR DOENÇAS RELACIONADAS AO RYR1 - A PERSPECTIVA DO PACIENTE/CUIDADOR".
⇓ ⇓ ⇓ ⇓
Publicação em 13 Julho de 2024
Resumo Histórico e objetivo: Variantes patogênicas do RYR1, o gene que codifica o principal canal de liberação de cálcio do retículo sarcoplasmático (RyR1) com um papel crucial no acoplamento excitação-contração da célula muscular, estão entre as causas genéticas mais comuns de distúrbios neuromusculares não distróficos. Recentemente, conduzimos um estudo via questionário com foco em deficiências funcionais, fadiga e qualidade de vida (QV) em pacientes com doenças relacionadas ao RYR1 (RYR1-RD) em todo o espectro de doenças reconhecidas. Neste referido estudo via questionário, a perspectiva médica foi adotada, refletindo um protocolo de estudo projetado por neurologistas e psicólogos. Com este estudo em questão, queríamos abordar especificamente a perspectiva do paciente.INTRODUÇÃO
Variantes patogênicas do RYR1, o gene que codifica o principal canal de liberação de cálcio do retículo sarcoplasmático (SR) (RyR1) com um papel crucial no acoplamento excitação-contração (ECC) nas célular musculares, são uma das causas genéticas mais comuns de distúrbios neuromusculares não distróficos. As variantes patogênicas do RYR1 dão origem a uma ampla variedade de doenças relacionadas ao RYR1 (RYR1-RD) que se apresentam ao longo da vida, variando de miopatias congênitas de início precoce a manifestações episódicas na idade adulta, incluindo hipertermia maligna durante anestesia e rabdomiólise por esforço em indivíduos que de outra forma seriam amplamente saudáveis [1, 2]. Esse amplo espectro clínico associado ao RYR1 é devido ao impacto funcional altamente variável de diferentes variantes patogênicas do RYR1, modo de herança, bem como tipo e localização de mutações específicas.
Recentemente, conduzimos um estudo via questionário com foco em deficiências funcionais, fadiga e qualidade de vida (QV) em pacientes holandeses exibindo todo o espectro clínico de RYR1-RD [3]. Pudemos demonstrar que tanto o RYR1-RD permanente quanto o episódico estão associados a um impacto substancial da doença, caracterizado por limitações funcionais e fadiga grave, resultando em perda significativa da QV. Os resultados deste estudo aumentaram a conscientização e o reconhecimento dos sintomas típicos em indivíduos afetados por RYR1-RD. Além disso, o estudo também melhorou o gerenciamento do paciente e definiu áreas específicas que precisam de mais pesquisas, particularmente sobre o impacto da doença associado a esses distúrbios neuromusculares comuns.
A perspectiva adotada no estudo de questionário anterior foi a perspectiva médica distinta, refletindo um protocolo de estudo elaborado por neurologistas e psicólogos. Muitos clínicos, no entanto, permanecem em grande parte inconscientes do impacto do RYR1-RD na vida diária de seus pacientes e de suas expectativas em relação a tratamentos futuros. Esses aspectos estão gradualmente se tornando um tópico de pesquisa em outras doenças neuromusculares [4, 5], mas ainda não foram abordados no RYR1-RD. Para abordar essas questões, os membros da RYR-1 Foundation, uma associação internacional de pacientes dedicada ao RYR1-RD, iniciaram uma pesquisa online antes de um workshop científico e da conferência internacional de pacientes dedicado a essas condições. Os resultados desta pesquisa demonstram a forte necessidade do paciente de compartilhar suas perspectivas em primeira mão com os principais especialistas internacionais em RYR1.
O “RYR-1-Related Diseases International Research Workshop: From Mechanisms to Treatments”, realizado de 21 a 22 de julho de 2022 em Pittsburg (PA, EUA), foi o primeiro workshop internacional de pesquisa liderado por pacientes dedicado exclusivamente ao RYR1-RD [6]. O objetivo científico do workshop era fornecer um fórum que conectasse os principais especialistas internacionais em doenças RYR1 (pesquisadores, clínicos e geneticistas) com indivíduos afetados, familiares e defensores de pacientes para compartilhar conhecimento, trocar ideias, formar colaborações e desenvolver novas estratégias para encontrar terapias eficazes. Objetivos adicionais eram desenvolver recomendações de consenso para prioridades clínicas/de pesquisa, identificar itens acionáveis necessários para levar o campo adiante e fornecer uma plataforma para os estagiários se envolverem com pacientes/familiares de RYR1 e líderes estabelecidos no campo. Durante este workshop, a equipe do estudo apresentou os resultados da pesquisa on-line e convidou doze pacientes a apresentarem seus depoimentos sobre viver com RYR1. Este manuscrito descreve os resultados da pesquisa do paciente e dos depoimentos individuais, usando uma abordagem de métodos mistos; empregando uma análise quantitativa da pesquisa e uma análise qualitativa dos depoimentos.
MÉTODOS
Equipe de estudo
A equipe de estudo que projetou e executou a pesquisa consistiu em 14 indivíduos, incluindo indivíduos afetados, familiares e defensores preocupados com RYR1-RD. Três desses indivíduos (DH, BS, JR) participaram de reuniões virtuais de especialistas científicos e médicos (AS, RD, NV) envolvidos no planejamento e organização do workshop internacional (de novembro de 2021 a junho de 2022).
Plano da pesquisa on-line
A equipe do estudo discutiu uma série de tópicos, com base no que ouviram de diferentes pacientes em discussões internas na RYR-1 Foundation, para gerar o primeiro conjunto de perguntas para avaliar e entender os desafios diários enfrentados por indivíduos que vivem com RYR1-RD. O conjunto resultante de perguntas foi posteriormente discutido com os especialistas científicos e médicos para avaliar as perguntas mais relevantes e chegar a um consenso sobre as perguntas finais com base na importância e relevância clínica. Isso resultou em uma pesquisa de 21 perguntas cobrindo cinco temas diferentes: Demografia (1–3); Diagnóstico (4–9); Sintomas e impacto da condição (10–12); Atividade física (13–16); e Pesquisa e estudos clínicos (17–21). A pesquisa completa está incluída como Dados suplementares A: Pesquisa on-line.
Esta pesquisa usou um design transversal descritivo e estava disponível para todos os indivíduos com RYR1-RD que atendiam aos critérios de inclusão por meio da plataforma de pesquisa on-line 'SurveyMonkey'. A pesquisa esteve ativa de 9 de maio a 25 de junho de 2022. Os critérios de inclusão incluíram: 1) Ter recebido um diagnóstico médico de RYR1-RD; e 2) Ser capaz de entender e escrever em inglês. Para indivíduos <5 anos de idade, os pais ou responsáveis legais foram convidados a responder à pesquisa. Indivíduos entre 5 e 17 anos foram convidados a envolver seus pais ou responsáveis legais para responder às perguntas.
Uma abordagem de amostragem proposital foi usada, e os quadros de amostragem incluíram: páginas do Facebook (FB), Twitter e Instagram da "The RYR-1 Foundation", "ryr1.org"; grupo do FB "RYR-1 Families"; página do FB "Living with RYR-1- Support Group"; página do FB "Central Core Disease & Minicore: a place for support, learning & friends" e lista de e-mail da The RYR-1 Foundation. As instruções específicas fornecidas foram: "Forneça o melhor palpite se você não tiver certeza absoluta"; e ‘Pule qualquer pergunta que você não queira responder’. Os participantes foram informados de que o objetivo da pesquisa era ajudar pesquisadores e especialistas a aprender mais e entender melhor o impacto de viver com um RYR1-RD, e ajudar pesquisadores a desenvolver novas estratégias para identificar e avaliar terapias adequadas.
Convite e instruções para depoimentos
Primeiramente, os pacientes que são membros da RYR1 Foundation foram convidados por e-mail. Daqueles que relataram estar interessados e da equipe do estudo, os participantes foram selecionados com base na idade, sexo, raça e tipo e gravidade do diagnóstico para representar uma ampla gama de indivíduos afetados por RYR1-RD. Essa seleção foi feita pelos pacientes que participaram do grupo de estudo. Um grupo de 12 indivíduos que foram direta ou indiretamente afetados por um RYR1-RD foram convidados a fornecer breves depoimentos (cerca de 7 minutos) durante o workshop internacional que resumem sua perspectiva sobre como é viver ou cuidar de alguém com RYR1-RD. Esses indivíduos foram instruídos a falar sobre o processo de diagnóstico, sintomas e impacto do RYR1-RD em sua vida diária, bem-estar físico e mental, seus tratamentos passados e atuais e expectativas de pesquisas futuras. Os participantes foram encorajados a incluir experiências, preocupações e ideias específicas para pesquisadores e especialistas médicos. As instruções escritas para os depoimentos são adicionadas como Dados suplementares B: Instruções para depoimentos.
Considerações éticas
As informações foram coletadas sem pedir aos entrevistados que revelassem suas identidades. Consequentemente, as informações enviadas não foram consideradas informações de saúde protegidas. Portanto, o Health Insurance Portability and Accountability Act (WMO)* não precisou controlar o uso dessas informações. Apesar disso, a RYR-1 Foundation manteve salvaguardas rígidas para proteger as informações do paciente de uso ou divulgação que não sejam consistentes com seus objetivos. Além disso, os autores realizaram aquisição, análise, interpretação e publicação de dados de acordo com as diretrizes de boas práticas clínicas da Radboud University Medical Center. Finalmente, o Radboud Research Ethics Committee considerou esta pesquisa não sujeita ao WMO (2024-17388).
Armazenamento e análise de dados
Dados quantitativos. Os dados da pesquisa foram armazenados anonimamente em um arquivo Excel e, posteriormente, transferidos para o SPSS. Estatísticas descritivas foram predominantemente usadas para caracterizar os dados (SPSS versão 27, IBM, Armonk, Nova York). Os gráficos foram preparados no software Graphpad Prism versão 9.5.0 (Graphpad Software, San Diego, CA, EUA). Os testes rho de Spearman foram usados para avaliar a relação entre sintomas, entre estado de deambulação e sintomas, idade do diagnóstico e sintomas, e estado de deambulação e frequência de exercícios. Os participantes também foram divididos em duas faixas etárias para comparar crianças a adultos (idade até 17 e ≥18 anos). Uma correção de Bonferroni foi aplicada para neutralizar múltiplas comparações entre os diferentes grupos de doenças RYR1-RD. ANOVAs unidirecionais foram usadas para comparar os diferentes RYR1-RD com relação ao número e tipo de sintomas físicos e psicológicos.
Dados qualitativos. Os pacientes que apresentaram seus depoimentos foram pseudoanonimizados: nas transcrições e análises, apenas os números dos participantes foram usados. Coletamos dados demográficos dos participantes, incluindo idade, sexo, diagnóstico e papel na comunidade de pacientes (paciente/pai/outro cuidador). Todos os depoimentos foram gravados em áudio. Os depoimentos que foram apresentados apenas verbalmente (n=9/12) foram transcritos na íntegra. Todos os depoimentos escritos foram complementados com informações adicionais das gravações. Os depoimentos escritos e transcritos na íntegra foram carregados no software Atlas-ti versão 8.1 e analisados usando uma análise temática [7, 8]. A análise temática é um método para identificar, analisar e relatar temas dentro dos dados [9]. Dois pesquisadores (LS e NV) analisaram os dados de forma independente por meio de um processo de comparação e raciocínio indutivos, partindo dos dados e do objetivo e não de teorias preexistentes. Esse objetivo era obter uma melhor compreensão da vida de um paciente afetado por um RYR1-RD, e expectativas e desejos em relação ao futuro. Os dois pesquisadores buscaram independentemente as unidades básicas de significado segmentando os dados e dando a esses segmentos rótulos conceituais que estavam intimamente relacionados às palavras dos participantes (codificação aberta). Ambos os autores compararam e discutiram esses códigos até chegarem a um consenso. Em seguida, eles identificaram relações entre os códigos abertos e agruparam esses códigos referentes ao mesmo fenômeno em categorias (codificação axial).
As categorias estavam parcialmente sobrepostas aos temas da pesquisa: Diagnóstico; Sintomas e impacto da condição; Tratamento e Expectativas. Para os temas principais, subtemas foram criados (vida antes do diagnóstico, diagnóstico, sintomas, efeito no funcionamento físico, efeito na vida diária, efeito na saúde mental, tratamento, expectativas e obtenção de conhecimento) e com três pesquisadores (LS, SC, NV) as citações mais significativas foram selecionadas por subtema que melhor representava os temas.
RESULTADOS
Um resumo conciso dos resultados da pesquisa e dos depoimentos foram incluídos no relatório do workshop [6]. Apresentamos aqui o conjunto de dados completo, começando com os dados quantitativos seguidos por dados qualitativos sobre os seguintes temas: 1) Diagnóstico; 2) Sintomas e impacto da condição; 3) Atividade física; 4) Tratamento; 5) Pesquisa e estudos clínicos e 6) Expectativas. Os temas 1 e 2 foram rediscutidos tanto na pesquisa quanto no depoimento. Os temas 3 e 5 foram discutidos apenas na pesquisa e os temas 4 e 6 apenas nos depoimentos. Nos depoimentos, todos os temas foram divididos em diferentes aspectos-chave.
RESPOSTAS
Pesquisa - A pesquisa foi respondida por 227 pacientes, pais ou outros cuidadores (143 mulheres e 84 homens). Para as perguntas que não foram respondidas por todos os participantes, é indicado quantos pacientes responderam às perguntas. As idades dos participantes variaram de 1 a 85 anos, com média de 37 ± 21 anos.
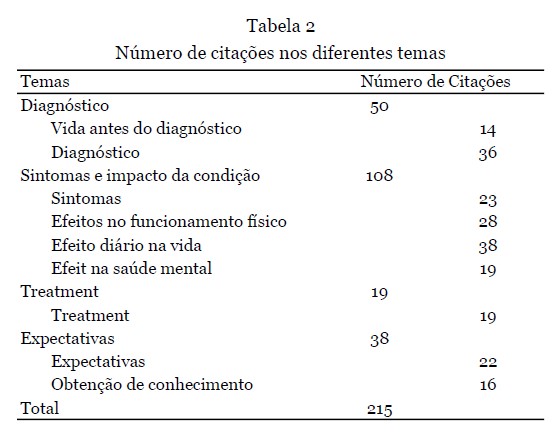
Depoimentos - 12 depoimentos foram apresentados durante o workshop. Nove deles foram fornecidos como texto escrito e complementados com a gravação de áudio, e os outros três estavam disponíveis apenas como gravação de áudio e transcritos na íntegra. Os dados demográficos dos participantes que forneceram os depoimentos são apresentados na Tabela 1. A análise qualitativa resultou na seleção de 215 citações, refletindo os quatro temas principais (Tabela 2).
Abaixo, descrevemos os resultados da pesquisa seguidos pelos resultados dos depoimentos de acordo com os principais temas de cada ferramenta de coleta de dados, conforme explicado na seção de métodos. Números de pacientes e porcentagens são relatados na pesquisa. Os casos em que nem todos os participantes responderam a uma pergunta específica são explicitamente indicados.
DIAGNÓSTICO
Resultados da Pesquisa - A seção de diagnóstico da pesquisa consistiu em seis perguntas. A idade dos entrevistados no diagnóstico foi variável, variando de 1 a > 60 anos. 22% dos participantes declararam que foram diagnosticados com RYR1-RD antes dos 5 anos de idade (Fig. 1). Os pacientes foram diagnosticados apenas por testes genéticos (n = 99/227,44%), por biópsia muscular e testes genéticos (n = 85/227,37%), ou apenas por biópsia muscular (n = 28/227,12%). Em um pequeno subconjunto de casos, o diagnóstico foi presumido com base no fenótipo e na presença de um parente de primeiro grau afetado com diagnóstico confirmado de RYR1-RD (n = 6/227,3%). Oito pacientes (4%) indicaram outras combinações dos modos de diagnóstico acima mencionados e um paciente não indicou o modo de diagnóstico.
Houve uma ampla gama de RYR1-RD, com a Miopatia Central Core (CCD) sendo a mais comum (n = 92/173, 53%). Suscetibilidade à Hipertermia Maligna (MHS) (n = 29/173,17%), Miopatia Centronuclear (CNM) (n = 10/173,6%), Desproporção Congênita do Tipo de Fibra (CFTD) (n = 9/173,5%) e Doença Multi-minicore (MmD) (n = 6/173,3%) foram outros diagnósticos, mas menos frequentes. 18 participantes indicaram "outro" para esta questão, com explicações de "incerto", "não especificado" ou "nova variante" (Fig. 2A). Nove pacientes tiveram um diagnóstico de MHS e miopatia. A herança foi autossômica dominante (AD) (n=61/215,28%), autossômica recessiva (AR) (n=59/215,27%), ou de novo ou espontânea (n=21/215,10%). Muitos dos participantes relataram não saber o modo de herança (n=74/215;34%) (Fig.2B).
Os participantes relataram sua capacidade física atual como capaz de andar sem assistência (n=145/223,65%), capaz de andar com assistência (n=27/223,12%), requer assistência de cadeira de rodas (n=13/223,6%) e requer uso de cadeira de rodas em tempo integral (n=38/223,17%). Pacientes com uma mutação ARordenovo necessitaram mais frequentemente do uso de cadeira de rodas em tempo integral (30,5% e 38% respectivamente, vs 5%, p < 0,001). Quase metade dos participantes considerou seus sintomas como progressivos (n = 107/223,47%), e um terço os relatou como estáveis (n = 77/223,34%). Outros não foram capazes de avaliar sua progressão devido a comorbidades ou sintomas variáveis.
Resultados dos depoimentos - Um total de 50 citações ilustraram o processo de diagnóstico (Tabela 3). Vários indivíduos mencionaram uma longa jornada de diagnóstico de meses a vários anos, chegando à idade adulta (início) quando foram diagnosticados, embora o início da doença tenha sido no nascimento. Alguns desses pacientes receberam um diagnóstico inicial incorreto, incluindo doença mitocondrial ou paralisia cerebral, antes que o diagnóstico correto de um RYR1-RD fosse finalmente estabelecido.
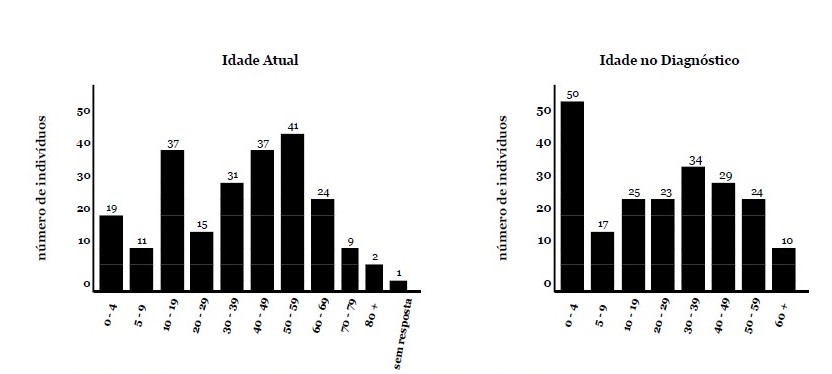
Fig. 1. A idade atual e a idade no diagnóstico. O eixo y descreve o número de pacientes para cada faixa etária. Esses histogramas mostram a ampla faixa da idade atual dos participantes e a idade no diagnóstico.
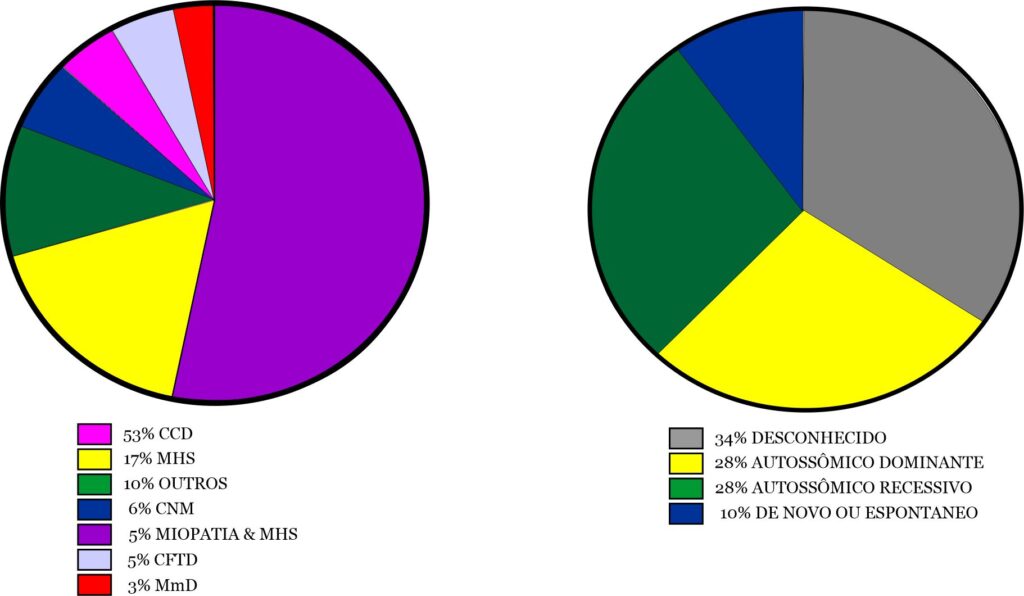
Fig. 2A. Genótipos dos pacientes incluídos. CCD: miopatia central core; MHS: suscetibilidade à hipertermia maligna; Outro: variante incerta, não especificada ou nova; CNM: miopatia centronuclear; CFTD: miopatia de desproporção do tipo de fibra congênita; MmD: miopatia multi-minicore. N=173. - Fig. 2B. Os diferentes modos de herança de RYR1-RD (N=215).
A vida antes do diagnóstico - Nas décadas de 1980 e 1990, pouca informação era conhecida sobre RYR1-RDs. O padrão de fraqueza, idade de início, sintomas específicos e a gravidade dos sintomas frequentemente resultavam em um amplo diagnóstico diferencial, e biópsias musculares eram frequentemente necessárias para confirmar o diagnóstico. Em geral, os pacientes comentaram sobre a dificuldade de ser diagnosticado com uma doença rara. Os pacientes ressaltaram o início precoce dos sintomas, incluindo atraso no desenvolvimento, mas também como esses primeiros sinais eram frequentemente ignorados ou reconhecidos somente após vários anos.
Diagnóstico - Em geral, os pacientes mencionaram seu histórico familiar de RYR1-RDs por meio de seus pais, irmãos ou outros membros da família, remontando a gerações. Eles relataram uma variabilidade intrafamiliar da gravidade da doença e a maneira como vivenciaram seu próprio diagnóstico ou o diagnóstico de seu filho. Um paciente mencionou que teve que esperar meses para consultar um especialista neuromuscular e, para alguns pacientes, levou anos para serem diagnosticados. Isso causou muito estresse para o paciente e sua família, principalmente por causa da incerteza associada. Pais sem formação médica enfrentaram desafios significativos para encontrar o caminho correto para o diagnóstico. Outros pais mencionaram que se sentiam solitários, pois não conheciam mais ninguém com uma experiência semelhante. Além disso, esses pais expressaram como a Fundação RYR-1 e a comunidade de pacientes os ajudaram. No geral, os pacientes descreveram seu processo de diagnóstico como uma longa jornada com muitas visitas ao hospital, testes adicionais e muitas perguntas sem resposta. Um dos pais mencionou o alívio que sentiu quando finalmente teve uma resposta para o diagnóstico de seu filho, embora não fosse o diagnóstico que esperavam ouvir. A maioria dos pais também expressou suas preocupações e estresse sobre a vida futura após o diagnóstico.

SINTOMAS E IMPACTO DA CONDIÇÃO
Resultados da pesquisa - Esta parte da pesquisa consistiu em três perguntas. A primeira pergunta sobre sintomas gerais propôs várias opções de resposta, incluindo, entre outras, fraqueza muscular geral, fadiga e dificuldades respiratórias, com uma opção aberta para listar outros sintomas. Os pacientes foram convidados a relatar todos os sintomas que se aplicavam a eles. Fraqueza muscular geral foi a mais frequentemente relatada (n = 190/227, 84%), seguida por fraqueza nas pernas (n = 185/227, 82%), dificuldade para correr (n = 183/227, 81%), dificuldade com escadas e para se levantar (n = 177/227, 78%) e fadiga (n = 168/227, 74%) (Fig. 3A e B). Para os sintomas acima mencionados, o grupo MHS teve uma frequência significativamente menor, exceto para fadiga, em comparação ao grupo miopatia. Não foram encontradas diferenças para esses sintomas entre diferentes faixas etárias (dados não mostrados). Também não houve correlação entre a idade do diagnóstico e o número de sintomas (r(210)=–0,79, p=0,253).
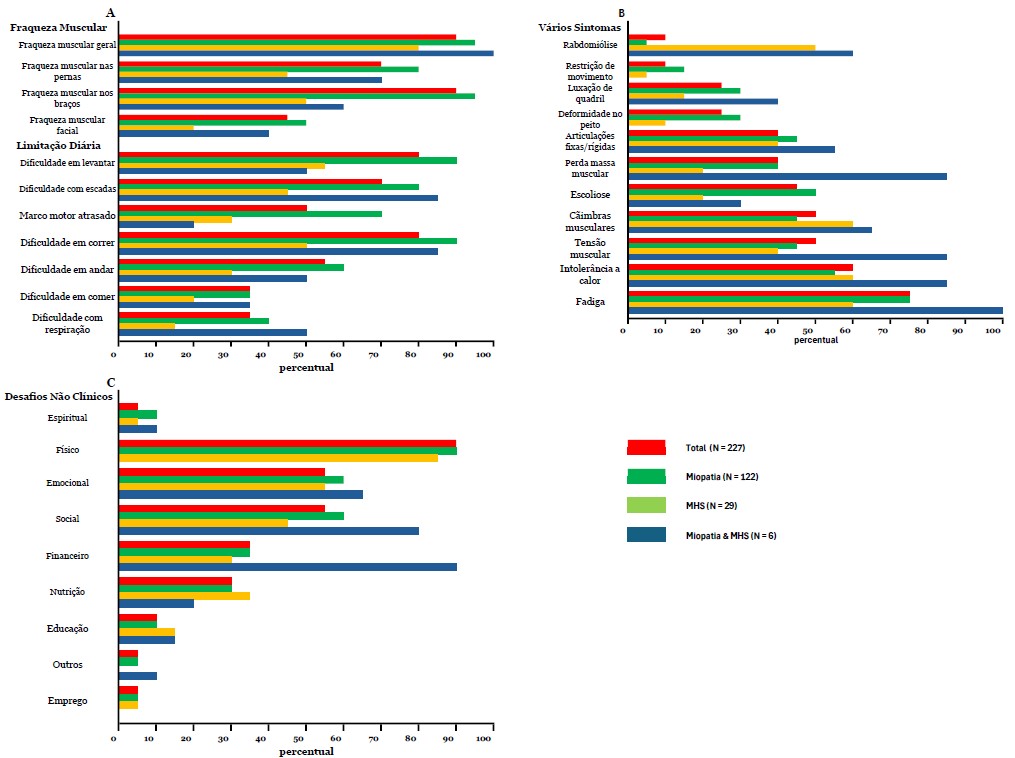
Fig. 3A, 3B, 3C. Sintomas Relatados - A porcentagem de pacientes por grupo RYR1-RD divididos em A) Fraqueza muscular e limitações na vida diária, B) Vários sintomas e C) Desafios não clínicos.
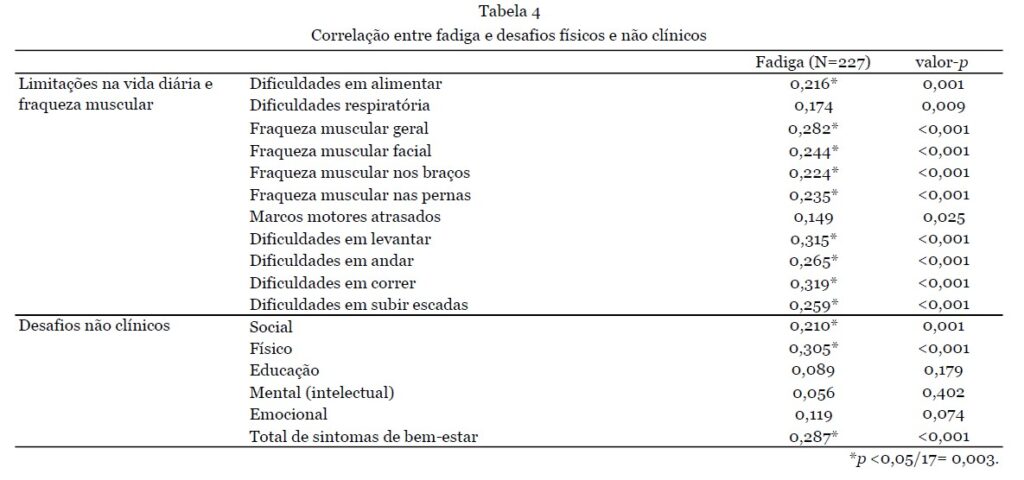
Os pacientes que necessitaram de uso integral de cadeira de rodas (n=38) ou caminharam com assistência (n=13) apresentaram significativamente mais sintomas do que aqueles capazes de caminhar sem assistência (n=145) (número médio de sintomas 13,5±3,3 e 11,6±3,8 vs. 9,12±4,2 respectivamente; p<0,001). Aqueles que necessitaram de uso integral de cadeira de rodas também relataram dificuldades respiratórias significativamente mais frequentes do que todos os outros grupos de mobilidade (0,76±0,43 vs. 0,26±0,44, 0,37±0,49 e 0,31±0,48; p<0,001). As dificuldades respiratórias não diferiram entre os diferentes tipos de RYR1-RD. A análise da diferença entre homens e mulheres resultou em um número total significativamente maior de sintomas para mulheres (10,8 ± 4,1 vs 9,2 ± 4,3; p = 0,004); em particular, as mulheres relataram fraqueza muscular generalizada com mais frequência (0,89 ± 0,32 vs 0,75 ± 0,44, p = 0,006). O modo de herança não teve influência na quantidade de sintomas. Ao correlacionar a fadiga com limitações na vida diária e fraqueza muscular, associações significativas foram encontradas para todos esses sintomas, exceto para dificuldades respiratórias e atrasos nos marcos motores, com dificuldades para correr e levantar tendo a maior correlação com a fadiga. No entanto, essas associações foram de ruins a razoáveis [10] (Tabela 4).
A segunda questão desta parte da pesquisa foi relacionada ao impacto do RYR1-RD no bem-estar geral. A questão "O RYR-1 afeta seu bem-estar em alguma das seguintes áreas" gerou as seguintes respostas: "fisicamente" (n = 202/227, 89%), "emocionalmente" (n = 145/227, 64%), "socialmente" (n = 132/227, 58%), financeiramente (n = 86/227, 38%), nutricionalmente (n = 60/227, 26%), educacionalmente (31/227, 12%) e espiritualmente (n = 18/227, 7%) (Fig. 3C). Além disso, os entrevistados foram solicitados a elaborar esta questão com comentários abertos (n = 168/227); exemplos de cada categoria destes são apresentados na Tabela 5.

Não foram encontradas diferenças entre os diferentes tipos de RYR1-RD (miopatia, MHS ou ambos) para os desafios não clínicos mais frequentemente mencionados (físicos, emocionais e sociais) ou o número total de desafios não clínicos. Ao diferenciar entre os diferentes estados de deambulação, os participantes que necessitam de uso de cadeira de rodas em tempo integral relataram manifestações sociais mais frequentemente e um maior número total de outros desafios não clínicos em comparação com aqueles capazes de andar sem ajuda (0,76 ± 0,43 vs 0,5 ± 0,50; p = 0,017 e 3,9 ± 1,7 vs 2,7 ± 1,6; p < 0,001, respectivamente). As mulheres relataram mais frequentemente seu bem-estar social como adversamente afetado em comparação aos pacientes do sexo masculino (0,64 ± 0,48 vs 0,48 ± 0,50; p = 0,018). Adultos indicaram com mais frequência que seu bem-estar emocional foi afetado negativamente em comparação com crianças (0,71±0,46 vs 0,48±0,50; p=0,001). Ao avaliar a correlação entre esses sintomas e fadiga, algumas associações significativas foram encontradas (Tabela 4) com apenas correlações fracas a razoáveis.
Resultados dos depoimentos - No total, 108 citações foram identificadas neste tema, com uma seleção de citações apresentadas na Tabela 6. Os sintomas mais comuns que surgiram os depoimentos dos pacientes foram físicos (em particular dor e fadiga) e sociais/emocionais, observando as barreiras físicas e mentais que o RYR1-RD introduziu em suas vidas. Muitos indivíduos indicaram um efeito benéfico da atividade regular e do exercício em seus sintomas, ao mesmo tempo em que expressaram preocupações e incertezas sobre quais tipos e frequência de atividades que podem ser mais benéficos, ao mesmo tempo em que tentam evitar dor excessiva e danos musculares. Vários indivíduos perguntaram sobre abordagens nutricionais que podem promover a saúde muscular. Outros compartilharam abordagens que eles experimentaram como benéficas, incluindo suplementação com creatina e magnésio.
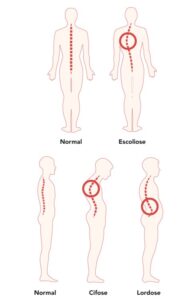
Sintomas - Os sintomas de RYR1-RD se apresentaram em alguns pacientes no nascimento e se desenvolveram mais tarde na vida em outros. Os sintomas congênitos incluíam quadris deslocados, pernas fraturadas e dificuldades físicas. Além disso, alguns pacientes tinham má oclusão dentária grave, exigindo cirurgia de mandíbula. Outros pacientes passaram por uma série de aparelhos ortopédicos e operações para tratar escoliose. Além das limitações físicas, sintomas não neuromusculares como fraqueza respiratória e fadiga crônica também foram relatados. Dificuldades de mastigação e/ou deglutição contribuíram para a dificuldade em manter o peso. Ser incapaz de regular a temperatura corporal, sofrer de cãibras nas pernas ou sentir dormência nas pernas foram sintomas adicionais mencionados. Em alguns pacientes, esses sintomas continuaram a piorar ao longo do tempo.
Efeito no funcionamento físico - No geral, os pacientes apresentaram dificuldades físicas significativas. Isso foi expresso principalmente por meio do atraso na obtenção de marcos motores e fraqueza muscular. Por exemplo, ser capaz de andar independentemente era um desafio. À medida que os pacientes envelheciam, os desafios permaneceram para outras atividades físicas, como subir escadas e/ou correr. Outras dificuldades mencionadas incluíam sentar, levantar, curvar-se, amarrar cadarços, ficar de pé por alguns minutos e manter o equilíbrio. A gravidade no funcionamento físico variou entre os participantes. Muitos pacientes relataram não ter conseguido acompanhar seus colegas na infância ou na idade adulta. Alguns (avós) pais expressaram como gostariam de acompanhar seus (netos). A maioria dos participantes usou várias ferramentas para lidar com suas dificuldades físicas. Um dos pais fez um triciclo personalizado para seu filho. Além disso, os pacientes usaram muletas de antebraço, bengalas, cadeiras de rodas e elevadores de cadeira. Embora a grande maioria dos participantes tenha compartilhado suas experiências com incapacidades físicas, alguns participantes mencionaram que haviam alcançado a maioria dos marcos motores e ainda eram capazes de viver uma vida sem dificuldade ou muita adaptação.
Efeito na vida diária - Os participantes enfatizaram o efeito da condição em sua vida diária e como vários sintomas afetaram sua qualidade de vida. Por exemplo, alguns participantes expressaram como a fadiga e o medo de cair impactaram sua vida diária. Enquanto alguns participantes tinham energia suficiente apenas para o trabalho, outros tiveram que se aposentar mais cedo devido à sua condição. A fadiga e a dor também foram relatadas como barreiras à participação social, sendo uma razão para alguns participantes evitarem sair. Um paciente explicou como havia pequenas coisas que eles não conseguiam fazer e que provavelmente seriam consideradas certas por pessoas saudáveis/outros indivíduos. Por exemplo, ser capaz de caminhar certas distâncias, subir um degrau ou lance de escadas e levantar objetos mais pesados. Apesar de suas limitações, os pacientes queriam ser independentes, e as crianças queriam acompanhar seus colegas. A maioria dos pacientes mencionou como eles ainda podem funcionar de forma independente, apesar de sua doença, especialmente com algumas modificações, por exemplo, usando uma cadeira de rodas (motorizada). Simultaneamente, eles também expressaram como eles precisavam de assistência com cuidados e apoio de outras pessoas. Os pacientes explicaram como eles conseguiram ir para a faculdade, se formar, ter uma vida social, cuidar de si mesmos e se sentir realizados e orgulhosos. No entanto, os pacientes também reconheceram como sua condição, pelo menos, os definia em parte, impactando escolhas e como eles sentiam que eram vistos pelos outros. Com a idade, esses desafios se tornaram mais frequentes e impactantes. Para os pacientes, um tratamento eficaz permitiria uma melhora na vida diária e se tornar/permanecer independente.
Efeito na saúde mental - RYR1-RD impactou pacientes e familiares, passando por um longo processo de aceitação da condição. Os pais se sentiam solitários e isolados às vezes, por não conhecerem ninguém em uma posição semelhante. Alguns pacientes falaram sobre as dificuldades que enfrentaram durante a infância. Os pacientes se sentiam envergonhados, por exemplo, sobre suas cicatrizes, e um indivíduo mencionou ter sofrido bullying por causa de um suporte lombar. Em geral, eles achavam difícil fazer amigos. Os familiares sentiam episódios de culpa e também tinham dificuldades em processar a condição. No geral, os pacientes vivenciavam sentimentos de decepção, derrota e tristeza. A sensação de ser diferente causava sentimentos de solidão. Além disso, também foi mencionado como os pacientes se sentiam muito gratos pelo apoio que recebiam da família, amigos e profissionais de saúde. A disposição dos profissionais de saúde em tentar entender e ajudar os pacientes era apreciada. Alguns pacientes mencionaram como sua religião e o apoio da família e dos amigos os fortaleceram. Enquanto um participante explicou a dificuldade de pedir ajuda, outro participante mencionou como amigos e familiares eram um incentivo para participar de atividades e se tornarem independentes. Apesar das dificuldades e impossibilidades vivenciadas pelos pacientes, também foi mencionado como alguns indivíduos tentaram se concentrar em todas as possibilidades que tinham. No entanto, houve uma necessidade de apoio profissional para a saúde mental expressa por pacientes e familiares.
ATIVIDADE FÍSICA
Resultados da pesquisa - Esta parte consistiu em quatro perguntas sobre o número e o tipo de atividade física e a preservação ou melhora da força experimentada. Os participantes relataram a frequência da atividade física como 1-2 vezes por semana (n=66, 29%), 3-4 vezes por semana (n=64, 28%), 5-6 vezes por semana (n=38, 17%) e pelo menos diariamente (n=23, 10%). Apenas 32 pacientes (14%) não participaram de atividade física ou exercício algum. A frequência da atividade física não diferiu entre os diferentes tipos de RYR1-RD. Para os participantes que necessitaram de assistência de cadeira de rodas, uma correlação moderadamente negativa foi encontrada entre a quantidade de exercício e a fadiga (r(12) =–0,622, p=0,023).
Uma ampla gama de atividades físicas específicas foi relatada por 193 pacientes, incluindo caminhada (n = 130/193, 67%), fisioterapia (n = 63/193, 33%), natação (n = 53/193, 27%), treinamento de peso e resistência (n = 39/193, 20%) e ciclismo (n = 33/193, 17%). A maioria dos pacientes relatou ser capaz de manter ou melhorar sua força e/ou resistência (n = 94/197, 48%), enquanto 52 pacientes (26%) não apresentaram melhora. Os outros participantes (n = 51/197, 26%) indicaram que não tinham certeza. Os motivos para não participar de esportes foram "Não consigo criar uma rotina de exercícios que funcione para mim" (23/40, 58%); ‘Estou preocupado com a minha segurança’ (n = 10/40, 25%); ‘Não acredito que o exercício físico irá manter ou melhorar a minha condição’ (n = 9/40, 23%); e ‘Não tenho tempo’ (n = 3/40, 8%).
TRATAMENTO
Resultados dos depoimentos - No total, 20 citações sobre tratamentos anteriores e em andamento foram identificadas. Uma seleção de citações é apresentada na Tabela 7.
Atualmente, não há tratamento definitivo disponível para RYR1-RD. No entanto, várias terapias estavam sendo usadas para ajudar a aliviar os sintomas. Além disso, um quarto dos pacientes relatou como otimizaram sua nutrição e suplementação, por exemplo, tomando creatina em pó para promover massa muscular, bem como várias vitaminas. Um paciente do MHS explicou como eles usaram dantrolene em baixa dosagem e como isso levou a uma qualidade de vida aceitável. Outro paciente usou ventilação não invasiva, permitindo um ganho de energia e um humor geral melhor. A maioria dos pacientes havia iniciado algum tipo de fisioterapia. Em alguns casos, isso foi combinado com terapia ocupacional e terapia da fala. Um paciente mencionou o uso de diferentes tipos de tratamento, como terapia de calor, massagem, ventosaterapia, mas também analgésicos para reduzir dores musculares e espasmos nas costas. Vários pacientes tiveram a oportunidade de participar de um ensaio clínico de medicamentos, com uma experiência geral positiva. Em geral, os participantes descreveram que, embora não se esperasse que o medicamento do estudo curasse a doença, ele tinha sido a única opção para potencialmente melhorar sua QV. Além disso, outro motivador para participar de um ensaio clínico ou tentar vários tipos de suplementos era encontrar um tratamento eficaz para os outros, especialmente para os pais e seus próprios filhos.

PESQUISA E ESTUDOS CLÍNICOS
Resultados da pesquisa - A parte final da pesquisa (cinco perguntas) abordou se os participantes participariam de ensaios clínicos e o que eles achavam que os pesquisadores precisavam saber sobre viver com um RYR1-RD. A questão se os participantes estariam dispostos a participar de um ensaio clínico foi amplamente respondida positivamente ('definitivamente participar' (n = 90/226, 40%), 'provavelmente participará' (n = 102/226, 45%), 'improvável participar' (n = 22/226, 10%) 'não participará' (n = 10/226, 4%). Os participantes que responderam negativamente o fizeram principalmente por preocupações com o impacto na rotina diária (n = 19/32,59%), preocupações com sua segurança (n = 16/32, 50%) e falta de crença em um tratamento ou cura (n = 2/32, 6%).
Com 154 pacientes respondendo a 'o que os pesquisadores precisam saber ou entender melhor sobre viver com RYR-1?', a maioria declarou muitas questões além das preocupações estritamente médicas (incluindo dor) que os pacientes enfrentam frequentemente em sua vida diária. Além disso, os participantes indicaram certas modificações nutricionais e medicamentos que achavam que poderiam ajudar com seus sintomas. Uma seleção dos As respostas a esta questão aberta são apresentadas na Tabela 8. Finalmente, as perguntas dos participantes para a comunidade médica se concentraram principalmente na melhoria do bem-estar físico e emocional (n = 167/210, 80%), no alívio dos sintomas diários (n = 107/210, 51%) e no impacto dos fatores ambientais (n = 129/210, 61%).
EXPECTATIVAS
Resultados dos depoimentos - Identificamos 38 citações sobre expectativas do curso natural da doença e desenvolvimentos em pesquisa. Uma seleção de citações é apresentada na Tabela 9.
Expectativas - Os participantes compartilharam seus pensamentos e expectativas em relação aos tratamentos futuros. Em geral, os participantes esperam um tratamento eficaz, pelo menos retardando a progressão de sua doença. Alguns participantes expressaram o desejo de recuperar a força, a resistência e a possibilidade de poder realizar atividades como correr, subir escadas ou levantar objetos. Outros participantes enfatizaram a motivação de ajudar outros pacientes e famílias, por exemplo, por meio da participação em ensaios clínicos para avançar ainda mais o conhecimento da doença e, ao mesmo tempo, retribuir algo à comunidade científica. Um participante mencionou o desejo de defender os outros e poder entrar em contato com esses pacientes. Vários participantes expressaram a necessidade de uma cura para si próprios e futuros pacientes para tratar sintomas como cãibras musculares, fadiga e oftalmoparesia. A expectativa de declínio da função ao longo do tempo foi percebida como preocupante. Enquanto um participante elaborou sobre a progressão da doença vivenciada, outro participante mencionou o medo de ser pai ou mãe de uma criança afetada e os possíveis desafios para o futuro.
Obtendo conhecimento - Os participantes enfatizaram a importância de obter conhecimento sobre a condição e possíveis tratamentos. A maioria dos participantes conduziu sua própria busca por informações, principalmente por curiosidade, mas também devido à falta de informações suficientes fornecidas por seus provedores de saúde. Além disso, um participante mencionou a importância de informações abrangentes, especialmente para pessoas com formação não científica e devido à grande quantidade de informações disponíveis. A maioria dos participantes expressou o quanto o diagnóstico significou para eles, mesmo com a ausência de cura. Simultaneamente, os participantes também elaboraram sobre o acesso ao suporte. Uma compreensão da doença e saber que a pesquisa está sendo conduzida foi considerada impactante. Poder conhecer pessoas com um diagnóstico semelhante e desafios semelhantes também foi útil. Os participantes tiveram contato com outras pessoas por meio de mídia social, e-mail e videochamadas. Era importante que os pacientes e familiares conhecessem seus pares e pudessem se relacionar com outras pessoas. O papel crucial da organização de pacientes também foi mencionado aqui, principalmente ao fornecer acesso à informação, abordar os desafios e conectar as pessoas. Por fim, muitas pessoas expressaram sua sincera gratidão pelo trabalho dos clínicos e pesquisadores da área, ao mesmo tempo em que os encorajaram a continuar progredindo no desenvolvimento da terapia.

DISCUSSÃO
Por meio da pesquisa realizada neste estudo, coletamos opiniões de pacientes com uma ampla gama de RYR1-RD (n = 227). Os resultados mostram que indivíduos de todas as idades são afetados por RYR1-RD e que a idade no diagnóstico varia amplamente. Pacientes com miopatia foram diagnosticados mais cedo do que aqueles com MHS (mediana de 18,5 e 29,0, respectivamente). A maioria dos pacientes, tanto com miopatia quanto com MHS, era ambulatória e aproximadamente metade dos participantes considerou sua doença progressiva. Com base nos resultados da pesquisa e 12 depoimentos, os pacientes relataram um grande impacto do RYR1-RD em suas vidas. A maioria dos entrevistados relatou estar envolvida em atividade física regular ou exercício, metade dos quais experimentou melhora de força e/ou resistência. Finalmente, a maioria dos pacientes estava disposta a considerar a participação em futuros ensaios clínicos.
Ao refletir sobre essas descobertas, notamos que os tipos relatados de RYR1-RD são semelhantes aos relatados em publicações anteriores na área, com CCD e MHS sendo os mais prevalentes [1,2]. No entanto, este estudo fornece a perspectiva mais abrangente do paciente até o momento sobre o amplo impacto da RYR1-RD na vida cotidiana, fornecendo insights únicos e importantes para consideração futura. Os participantes relataram múltiplos domínios da vida diária influenciados por sua doença: físico, social, emocional e, com menos frequência, financeiro, nutricional e espiritual. Apenas 8% dos participantes relataram que a RYR1-RD não impactou seu bem-estar geral. Essas descobertas estão de acordo com um estudo recente sobre a qualidade de vida relacionada à saúde em indivíduos afetados com RYR1-RD [11]. Os domínios mais valiosos revelados pelas análises qualitativas deste estudo foram a importância dos impactos sociais, o desenvolvimento de estratégias de enfrentamento, tanto físicas quanto psicológicas, e a identificação de fadiga e fraqueza como sintomas principais.
Os achados apoiam observações anteriores de um estudo de questionário em pacientes holandeses com RYR1-RD, demonstrando comprometimentos funcionais substanciais e fadiga crônica em comparação com controles saudáveis [3]. Como esperado, descobrimos que fadiga, dor e dificuldades físicas e sociais associadas foram mais pronunciadas em indivíduos com miopatias congênitas relacionadas ao RYR1 em comparação com indivíduos com MHS. O bem-estar emocional foi mais impactado em adultos do que em crianças. As crianças geralmente foram diagnosticadas em uma idade mais precoce, provavelmente devido ao recente aumento do conhecimento científico e médico sobre RYR1RD. A maioria dos adultos se lembra de saber apenas que algo estava errado quando eram jovens, mas não o que era e como lidar com isso. Para a maioria dos pacientes adultos, seu diagnóstico foi uma longa jornada tortuosa que levou muitos anos e também impactou significativamente outros membros da família.
Além disso, nossos resultados mostraram uma baixa correlação entre fadiga e vários outros sintomas, como fraqueza muscular. No entanto, a fadiga resultou em uma carga significativa em suas vidas diárias. A fadiga é influenciada por vários fatores, direta ou indiretamente [12]. Portanto, as correlações separadas podem ser baixas, mas o impacto na fadiga alto. Concluímos que casos relativamente leves do espectro clínico RYR1-RD estão, no entanto, associados a fadiga grave e limitações funcionais, resultando em perda substancial de qualidade de vida [3]. Por exemplo, a carga diária experimentada por indivíduos com MHS foi confirmada em nosso recente estudo transversal, mostrando uma alta prevalência de sintomas neuromusculares, como mialgia, cãibras musculares e fadiga, resultando em consultas médicas frequentes para identificar a causa desses sintomas [13]. Consistente com isso, a combinação de sintomas neuromusculares e não neuromusculares ocasionalmente piorando ao longo do tempo foi descrita nos depoimentos de alguns pacientes.
Pacientes com RYR1-RD relataram ser fisicamente ativos, frequentemente praticando caminhada, ciclismo, fisioterapia e natação ou hidroginástica, sem diferença na frequência de treinamento entre indivíduos com diferentes tipos de RYR1-RD. Notavelmente, treinamento com pesos ou resistência também foi relatado por 17% de todos os pacientes, atividades geralmente não recomendadas para indivíduos com miopatias [14–16]. Uma ampla gama de outras atividades físicas e esportes foram relatados, incluindo passeios a cavalo, ioga e pilates. Dificuldades em encontrar uma forma adequada de exercício ou preocupações com a segurança foram relatadas como barreiras específicas à participação em atividades físicas. Assim, a orientação sobre formas recomendadas de exercício, fisioterapia e treinamento poderia ser adicionada às diretrizes de cuidados clínicos recentemente desenvolvidas pela RYR-1 Foundation [17]. Descobriu-se que os pacientes faziam uso de várias ferramentas para lidar com suas lutas físicas. A função física diferiu entre os pacientes, e alguns expressaram como sentiam que ainda poderiam viver uma vida sem dificuldade ou muita adaptação. No entanto, a perda de força e resistência ao longo do tempo pode ser uma barreira significativa para vários tipos de atividades. Os pacientes estavam cientes do impacto emocional de sua doença e, portanto, precisam de recursos para ajudá-los a lidar com esses sentimentos, algo especialmente vivenciado pelos pais. Uma mistura semelhante de respostas emocionais também foi relatada nos depoimentos. Embora alguns pacientes tenham mencionado aspectos emocionais desafiadores associados à vida com um RYR1RD, o apoio da família, amigos e profissionais de saúde os ajudou a lidar com esses sentimentos.
Finalmente, este estudo também ofereceu uma perspectiva muito útil e única do paciente sobre futuros ensaios clínicos. A maioria dos participantes indicou que eles estavam (provavelmente) dispostos a participar, com as principais barreiras à participação sendo o impacto antecipado nas atividades da vida diária e preocupações com a segurança. Esta informação é importante, pois a perspectiva do paciente e a consideração de potenciais barreiras à participação são altamente relevantes para o desenho de ensaios clínicos e estão sendo cada vez mais consideradas. Embora as perspectivas já tenham sido fornecidas por grupos de defesa do paciente para atrofia muscular espinhal [5, 18], esta contribuição valiosa ainda está faltando para muitas outras condições neuromusculares. Alguns participantes também relataram suas experiências relacionadas a ensaios clínicos em andamento ou concluídos. Pesquisas futuras devem se concentrar na perspectiva do paciente em relação às expectativas terapêuticas e ao desenho de ensaios clínicos, o que pode melhorar significativamente o recrutamento, a retenção e os resultados do estudo [5].
Este estudo tem várias limitações. Primeiro, como a participação na pesquisa foi anônima, o diagnóstico foi relatado pelos pacientes e não pôde ser verificado de forma independente pelos clínicos que os diagnosticaram. Esta foi uma escolha deliberada dos pacientes que iniciaram esta pesquisa para reduzir o viés de averiguação, não limitando a participação a indivíduos com contato recente com profissionais de assistência médica. Segundo, o desenho do estudo inclui um viés de averiguação para indivíduos com acesso à internet e que foram informados sobre a RYR-1 Foundation e suas atividades. Terceiro, a pesquisa consistiu apenas em perguntas personalizadas. Os pesquisadores consideraram adicionar questionários validados sobre habilidades funcionais ou fadiga, mas deliberadamente escolheram não fazê-lo e se concentrar nas questões levantadas pela comunidade de pacientes. Sendo um questionário não validado, as formulações de certas perguntas podem ter levado a diferentes interpretações, possivelmente impactando os resultados. Por exemplo, esperava-se que as dificuldades respiratórias fossem mais frequentes para pacientes com miopatia congênita em comparação com MHS. No entanto, isso não foi encontrado nos resultados da pesquisa, o que pode refletir diferentes interpretações dos participantes sobre o que constitui dificuldades respiratórias. Se uma pergunta sobre o bem-estar dos participantes não revelar um problema específico, isso não significa necessariamente que o aspecto específico do bem-estar não seja diferente em comparação com indivíduos sem miopatia subjacente ou RYR1-RD. Por exemplo, se os participantes fizessem alterações em seu programa escolar, seu bem-estar educacional poderia ser como o de indivíduos sem miopatia subjacente ou RYR1-RD porque eles podem ir à escola como acharem adequado. No entanto, as perguntas usadas nesta pesquisa fornecem uma ideia geral de como os participantes são impactados por sua doença. Finalmente, a pesquisa estava disponível apenas em inglês, o que pode ter resultado em uma população de estudo que não é globalmente representativa.
Um ponto forte importante deste estudo é que a pesquisa foi realizada como um esforço colaborativo entre a comunidade de pacientes, uma organização de defesa de pacientes (RYR-1 Foundation) e clínicos-pesquisadores. As questões abordadas são tópicos importantes para a comunidade de pacientes. O design e a execução da pesquisa, bem como a apresentação dos resultados da pesquisa e depoimentos dos pacientes durante o workshop, foram apoiados e facilitados pela RYR-1 Foundation e os resultados foram avaliados quantitativa e qualitativamente em consulta com pesquisadores acadêmicos. No entanto, este estudo foi conduzido principalmente por pacientes e famílias do RYR1-RD, o que resultou em uma participação robusta, um aspecto cuja importância é cada vez mais reconhecida pelas autoridades regulatórias e de reembolso.
Concluindo, este estudo fornece uma perspectiva única do paciente sobre a jornada diagnóstica, o impacto da doença, os desafios psicossociais, as atividades físicas, bem como as expectativas do paciente para tratamentos futuros e ensaios clínicos de indivíduos com RYR1-RD.
AGRADECIMENTOS
Os autores gostariam de agradecer à equipe do RYR-1 Foundation Study que projetou e executou o estudo e a todos os participantes deste estudo pelo tempo dedicado a concluir a pesquisa e por compartilhar seus depoimentos. Vários autores desta publicação são membros do Netherlands Neuromuscular Center (NL-NMD) e da European Reference Network for rare neuromuscular diseases (EURO-NMD).
FINANCIAMENTO
Este trabalho foi apoiado financeiramente pelo Princes Beatrix Fund (número de concessão W.OR22-10) e pelos Institutos Nacionais de Saúde (número de concessão AR078000).
CONFLITO DE INTERESSE
Heinz Jungbluth é um membro do Conselho Editorial deste periódico, mas não esteve envolvido no processo de revisão por pares nem teve acesso a nenhuma informação sobre sua revisão por pares. Os outros autores não relatam mais conflitos de interesse.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS
Devido à natureza desta pesquisa, os participantes deste estudo não concordaram que seus dados fossem compartilhados publicamente, portanto, dados de apoio não estão disponíveis.
MATERIAIS SUPLEMENTARES
O material suplementar está disponível na versão eletrônica deste artigo: https://dx.doi.org/ 10.3233/JND-240029.
REFERÊNCIAS
[1] Snoeck M,vanEngelen BG, K¨ usters B, Lammens M, Meijer R, Molenaar JP, et al. RYR1-related myopathies: A wide spectrum of phenotypes throughout life. Eur J Neurol. 2015;22(7):1094-112.
[2] Lawal TA, Todd JJ, Meilleur KG. Ryanodine receptor 1related myopathies: Diagnostic and therapeutic approaches. Neurotherapeutics. 2018;15(4):885-99.
[3] van Ruitenbeek E, Custers JAE, Verhaak C, Snoeck M, Erasmus CE, Kamsteeg EJ, et al. Functional impairments, fatigue and quality of life in RYR1-related myopathies: A questionnaire study. Neuromuscul Disord. 2019;29(1): 30-8.
[4] Ramos-Platt L, Elman L, Shieh PB. Experience and perspectives in the US on the evolving treatment landscape in spinal muscular atrophy. Int J Gen Med. 2022;15: 7341-53.
[5] GussetN,StalensC,StumpeE,KlouviL,MejatA,Ouillade MC, de Lemus M. Understanding European patient expectations towards current therapeutic development in spinal muscular atrophy. Neuromuscul Disord. 2021;31(5):41930.
[6] O’ConnorTN,vandenBersselaarLR,ChenYS,NicolauS, Simon B, Huseth A, et al. RYR-1-related diseases international research workshop: From mechanisms to treatments pittsburgh, PA, U.S.A., 21-22 July 2022. J Neuromuscul Dis. 2023;10(1):135-54.
[7] Priest H, Roberts P, Woods L. An overview of three different approaches to the interpretation of qualitative data. Part 1: Theoretical issues. Nurse Res. 2002;10(1): 30-42.
[8] Vaismoradi M, Turunen H, Bondas T. Content analysis and thematic analysis: Implications for conducting a qualitative descriptive study. Nurs Health Sci. 2013;15(3): 398-405.
[9] Braun V, Clarke V. Using thematic analysis in psychology. Qualitative Research in Psychology. 2006;3(2):77-101.
[10] Akoglu H. User’s guide to correlation coefficients. Turk J Emerg Med. 2018;18(3):91-3.
[11] Capella-Peris C, Cosgrove MM, Chrismer IC, EmileBacker M, Razaqyar MS, Elliott JS, et al. Mixed methods analysis of Health-Related Quality of Life in ambulant individuals affected with RYR1-related myopathies pre-post-N-acetylcysteine therapy. Qual Life Res. 2020;29(6):1641-53.
[12] Kalkman JS, Schillings ML, Zwarts MJ, van Engelen BG, Bleijenberg G. The development of a model of fatigue in neuromuscular disorders: A longitudinal study. J Psychosom Res. 2007;62(5):571-9.
[13] van den Bersselaar LR, Jungbluth H, Kruijt N, Kamsteeg E-J, Fernandez-Garcia MA, Treves S, et al. Neuromuscular symptoms in patients with RYR1-related malignant hyperthermia and rhabdomyolysis. Brain Communications. 2022;4(6).
[14] VoetNBM.Exerciseinneuromusculardisorders:Apromising intervention. Acta Myol. 2019;38(4):207-14.
[15] Voet NB, van der Kooi EL, van Engelen BG, Geurts AC. Strength training and aerobic exercise training for muscle disease. Cochrane Database Syst Rev. 2019;12(12): Cd003907.
[16] AfridiA,RathoreFA.Whataretheeffects of strength training and aerobic exercise training for muscle disease?- A Cochrane Review summary with commentary. J Rehabil Med. 2021;53(9):jrm00231.
[17] RYR1 Foundation. Chapter 9: Physical Activity and Physical Therapy (PT); 2022 [cited 2022 Nov]. Available from: https://ryr1.org/online-resources-category/physicalactivity-physical-therapy.
[18] McGrawS,Qian Y, Henne J, Jarecki J, Hobby K, Yeh WS. Aqualitative study of perceptions of meaningful change in spinal muscular atrophy. BMC Neurol. 2017;17(1):68.
Por 44 anos vivi sem diagnóstico, ou ainda pior, com diagnósticos errados, depois do diagnóstico vivi sem informações sobre a doença, e sem saber se a ciência se movimentando em favor da doença que me afetava. Daí a razão em ter lançado o SorRYR-1, com o propósito de transmitir minhas experiências de vida, sobre por exemplo como fiz para chegar até aqui, mas também de informar a sociedade sobre a doença, aconselhar indivíduos afetados e seus familiares, além de participar e suportar pesquisas que possam de alguma forma beneficiar os portadores de uma doença relacionada à mutação no gene RYR1.
Atualmente me considero realizado na medida em que vejo os obejtivos traçados originalmente com a concepção do SorRYR-1 se cumprir. E na esteira desta constante linha de trabalho, recentemente tive a oportunidade e honra de contribuir através da Fundação RYR-1 com o financiamento de um Estudo de Prevalência liderado por Heinz Jungbluth, MD, PhD, do King's College London, uma autoridade de renome em Doenças Relacionadas ao RYR-1 (RYR-1-RD). Este estudo ocorrerá com a multi colaboração de diversos centros de pesquisa na Europa.
A necessidade urgente de avanços na compreensão científica ressalta a urgência da pesquisa e desenvolvimento de tratamentos eficazes visando a cura e melhoria da qualidade de vida do indivíduo portador de uma doença relacionada ao RYR1, justificando assim o estudo em questão.
O Estudo de Prevalência é uma pesquisa que visa determinar a frequência com que uma determinada doença afeta uma população específica. No caso específico, o trabalho acontecerá com indivíduos portadores de doenças relacionadas à mutação do RYR1.
Entendo que o estudo deverá envolver a coleta de dados de indivíduos identificados com os tipos diagnosticados da doença, análise genética para identificar mutações no RYR-1, avaliação de fatores demográficos, e clínicos que possam influenciar a prevalência. Os resultados dessa pesquisa deverá ajudar a entender a magnitude do impacto dessas doenças, identificar o universo de indivíduos afetados, classificar grupos, e informar estratégias de saúde pública e intervenções médicas. Ao estabelecer a real prevalência das doenças relacionadas ao RYR-1, este estudo esperançosamente deverá propiciar a alavancagem de mais investimentos por empresas farmacêuticas, pesquisadores, empresas de biotecnologia e empresas de capital de risco. Em última análise, a esperança é que o resultado deste trabalho acelere ainda mais o desenvolvimento de terapias para doenças relacionadas ao RYR-1.
“Strength In Numbers” é o grande mote da Fundação RYR1, e que nos move enquanto comunidade de indivíduos portadores de doenças relacionadas ao RYR1 para chegarmos a uma solução como tratamento e cura.
Responder perguntas relacionadas à miopatia que me acomete é um dos meus propósitos com o SorRYR-1. Uma pergunta que sempre me fazem, e a resposta sempre causa uma certa confusão a quem respondo é o fato de meu CPK ser normal. Acredito que isso se dá pela desinformação de muitas pessoas entender que as miopatias estão diretamente ligadas a uma alteração dos níveis de CPK.
O CPK, também conhecido como creatinoquinase, é uma enzima encontrada no tecido muscular. Os níveis elevados de CPK podem indicar danos ou lesões nos músculos, coração ou cérebro. No entanto, é importante considerar que os níveis de CPK podem variar de pessoa para pessoa, e existem também várias condições de saúde e atividades físicas que podem levar a um aumento temporário nos níveis de CPK. Uma outra questão que os cientistas ainda pesquisam, e não tem uma resposta, é sobre porque os níveis de CPK se comportam de forma diferente nas miopatias, em alguns individuos em níveis alterado, em outros normal.
Os níveis elevados de CPK podem ser indicativos de várias condições de saúde, como exemplo:
Em uma miopatia, os níveis de creatinoquinase (CPK ou CK) podem variar, dependendo do tipo e da causa da miopatia. Em alguns casos, os níveis de CPK podem estar elevados, enquanto em outros casos podem ser normais ou até mesmo baixos. Portanto, não há uma resposta definitiva sobre o porquê dos níveis de CPK estarem altos ou baixos em uma miopatia, assim, é importante consultar um médico para obter um diagnóstico preciso e interpretar corretamente os resultados dos exames.
No meu caso com diagnóstico de Miopatia Congênita Centronuclear, sempre tive meus resultados de exames sempre com o CPK no nível da normalidade, portanto, é importante ressaltar que o diagnóstico da miopatia não é baseado exclusivamente nos níveis de CPK, mas sim por uma combinação de sintomas clínicos, exames de imagens, exame genético, biópsia muscular, dentre outros exames.
Assim sendo, é importante lembrar que os níveis de CPK devem ser interpretados em conjunto com outros sintomas e exames clínicos. E caso haja suspeita de Miopatia, é fundamental realizar uma avaliação médica completa com um especialista em doenças neuromusculares para obter um diagnóstico preciso. O médico irá considerar todos os aspectos clínicos e resultados de exames para chegar a um diagnóstico correto.
Existem postagem a respeito da conceituação do Símbolo Internacional de Acesso e Símbolo Internacional de Acessibilidade que ao contrário de esclarecer o assunto, deve gerar e alimentar mais confusão no entendimento de algumas pessoas. Coincidentemente cheguei de uma viagem a Irlanda, Escócia, e Noruega, e tive a oportunidade de ver os dois símbolos cumprindo harmonicamente com seus propósitos. Os símbolos são bem diferentes, têm conceitos e propósitos distintos, e ao contrário do que alguns indivíduos entendem e dizem, em momento nenhum a criação de um símbolo teve ou tem o objetivo de substituir o outro símbolo.
O Símbolo Internacional de Acesso se refere a um ícone internacionalmente reconhecido que representa a acessibilidade para pessoas com mobilidade reduzida. Esse símbolo foi criado em 1968 por um designer dinamarquês, é representado por uma figura humana em uma cadeira de rodas e é amplamente utilizado para indicar a presença de rampas, elevadores, banheiro adaptado, e outras instalações acessíveis em edifícios e espaços públicos.
Por outro lado, o Símbolo Internacional de Acessibilidade criado em 2015 pelo Departamento de Informações Públicas da Organização das Nações Unidas (ONU), é representado por uma figura humana com os braços abertos, simétrica conectada por quatro pontos a um círculo, representando a harmonia entre o ser humano e a sociedade, simbolizando a inclusão de pessoas com todas as habilidades, em todos os lugares. Enfim, a ideia do símbolo é mais abrangente, e deve ser utilizado em produtos e locais acessíveis, aumentando a consciência sobre as necessidades e direitos das pessoas com deficiência física, deficiência visual, auditiva, intelectual, entre outras, e assim promover a inclusão em todas as áreas da sociedade.
Os símbolos de acessibilidade para diferentes tipos de deficiência desempenham um papel importante na conscientização e na criação de uma sociedade inclusiva. Aqui estão algumas maneiras pelas quais esses símbolos podem aumentar a conscientização:
1. Reconhecimento visual: Os símbolos de acessibilidade são visualmente distintos e facilmente reconhecíveis. Ao ver esses símbolos em locais públicos, as pessoas são lembradas da diversidade de necessidades e capacidades das pessoas com deficiência. Isso ajuda a normalizar a presença de pessoas com deficiência na sociedade.
2. Informação e orientação: Os símbolos de acessibilidade ajudam a fornecer informações e orientações sobre as instalações e serviços disponíveis para pessoas com deficiência. Por exemplo, um símbolo de acessibilidade auditiva indica a presença de recursos de comunicação para pessoas com deficiência auditiva, como sistemas de amplificação sonora ou intérpretes de Libras. Isso ajuda as pessoas com deficiência a identificar e utilizar esses recursos.
3. Inclusão e respeito: Ao utilizar símbolos de acessibilidade para diferentes tipos de deficiência, a sociedade demonstra respeito e inclusão para com as pessoas com deficiência. Esses símbolos enviam uma mensagem de que todas as pessoas, independentemente de suas habilidades, são valorizadas e têm direito a participar plenamente da sociedade.
4. Sensibilização e educação: Ao ver os símbolos de acessibilidade regularmente, as pessoas são expostas à diversidade de deficiências e às necessidades únicas de cada pessoa. Isso promove a sensibilização e a educação sobre as questões relacionadas à deficiência, desafiando estereótipos e aumentando a compreensão e empatia em relação às pessoas com deficiência.
Em resumo, o Símbolo Internacional de Acesso é específico para representar a acessibilidade para pessoas com mobilidade reduzida, enquanto o Símbolo Internacional de Acessibilidade, com sentido mais amplo, engloba uma variedade de deficiências, e visa indicar que um determinado local está preparado para receber os portadores de necessidades especiais, demonstrando respeito e inclusão, disponibilizando informações e orientações específicas, além de promover a sensibilização e a educação sobre as questões relacionadas à deficiência, desafiando estereótipos e aumentando a compreensão e empatia em relação às pessoas com deficiência. Ambos os símbolos são importantes para a normalizar a presença de pessoas com deficiência na sociedade criando uma convivência inclusiva e igualitária, garantindo que todas as pessoas tenham igualdade de acesso e oportunidades. Concluindo, portanto não faz sentido, e nem existe a possibilidade de um símbolo substituir o outro símbolo.
Buscando estar sempre conectado com as notícias relacionadas e de interesse dos portadores de mutação no gene RYR1, mais especificamente a Miopatia Congênita Centronuclear, que se trata da doença que me acomete, tomei conhecimento da recente pré-publicação científica, intitulada, “O Propofol liga-se diretamente e inibe o receptor 1 de rianodina do músculo esquelético (RYR1)”, versão postada em 12 de janeiro de 2024, na qual os pesquisadores, Thomas T. Joseph, MD, PhD¹, Weiming Bu, PhD¹, Omid Haji-Ghassemi, PhD², Yu Seby Chen, PhD², Kellie Woll, PhD², Paul D. Allen, MD, PhD⁴, Grace Brannigan, PhD³, Filip Van Petegem, PhD², Roderic G. Eckenhoff, MD¹, através de resultados obtidos em estudos e ensaios sugerem em seus relatos que o propofol, um agente anestésico intravenoso de curta ação, em concentrações clínicas, se liga ao receptor de rianodina tipo 1 (RYR1), inibindo sua abertura, podendo assim, prevenir as manifestações clínicas da Hipertermia Maligna (HM), mesmo com exposição a agentes desencadeantes como os anestésicos voláteis.
Confira a integra da publicação pelo seguinte link: https://www.biorxiv.org/content/10.1101/2024.01.10.575040v1.full
O receptor de rianodina tipo 1 (RYR1) desempenha um papel central na determinação de quando (tempo), e quanta (quantidade) força é produzida pelos músculos esqueléticos, que é necessária e essencial para movimentação do corpo e atividades físicas diárias dos indivíduos. Como principal canal de liberação de íon de cálcio (Ca²⁺) no retículo sarcoplasmático do músculo esquelético, a mutação genética no receptor de rianodina tipo 1 (RYR1), tem a ela subjacentes, algumas doenças ou distúrbios musculares, tais como a Miopatia Centronuclear, Miopatia Central Core, Miopatia Multi-Minicore, Desproporção Congênita do Tipo de Fibra, incluindo distúrbios como a Rabdomiólise por Esforço, e a Hipertermia Maligna (HM).
Em pacientes com a mutação no gene RYR1, “a crise” de Hipertermia Maligna, causada pela exposição a algumas drogas desencadeantes, como os anestésicos voláteis halogenados, pode direcionar o RYR1 a deixar o canal de rianodina em um estado aberto, resultando em uma liberação descontrolada de Ca²⁺, acarretando em tensão no sarcômero, e consequente produção de calor. A restauração de Ca²⁺ no retículo sarcoplasmático também consome ATP (adenosina trifosfato), molécula responsável pelo depósito de energia celular, gerando também por consequência uma carga metabólica adicional insustentável.
Ao anestesiar pacientes com mutações genéticas conhecidas pela suscetibilidade a Hipertermia Maligna, o anestésico geral intravenoso não desencadeante propofol é comumente substituído por anestésicos desencadeantes. As evidências de ligação direta de agentes anestésicos ao RYR1 ou seus parceiros de ligação são escassas, e as interações em nível atômico do propofol com o RYR1 são totalmente desconhecidas. Os pesquisadores mostram no trabalho acima descrito que o propofol diminui a abertura do receptor do canal de rianodina (RYR1) com vesículas no retículo sarcoplasmático e bicamadas lipídicas planas, e que inibe a liberação de Ca²⁺ induzida por ativador do retículo sarcoplasmático no músculo esquelético humano. Além de confirmar a ligação direta, a marcação por fotoafinidade usando m-azipropofol (AziPm) revelou vários supostos locais de ligação de propofol no RYR1. A projeção pela simulação dinâmica da afinidade de ligação molecular sugere que o propofol se liga a pelo menos um destes locais em concentrações clínicas. Esses achados convidam à hipótese de que, além de o propofol não desencadear a Hipertermia Maligna, ele também pode ser protetor contra a Hipertermia Maligna, inibindo o fluxo induzido de Ca²⁺ através do canal de rianodina - RYR1.
¹ Department of Anesthesiology and Critical Care, Perelman School of Medicine, University of Pennsylvania, Philadelphia, PA USA; ² Department of Biochemistry, University of British Columbia, Vancouver, BC, Canada; ³ Department of Physics and Center for Computational and Integrative Biology, Rutgers University, Camden, NJ USA; ⁴ Department of Anesthesiology, University of Tennesee, Knoxville, TN USA
O artigo acima mencionado foi publicado na bioRxiv, repositório aberto de pré-publicação direcionado as ciências biológicas (https://www.biorxiv.org/), e hospedado pelo Cold Spring Harbor Laboratory (CSHL).
As doenças relacionadas ao RYR1 são identificadas com base em sua classificação histopatológica, isto é, pela aparência da biópsia do músculo na lâmina do microscópio. A diferenciação encontrada na biópsia designará o tipo da doença, se é por exemplo, Miopatia Central Core, Miopatia Multiminicore, Miopatia Centronuclear, ou Desproporção Congênita de Tipos de Fibras.
A Miopatia Congênita Centronuclear (MCCN) e a Miopatia Central Core (MCC) são ambas doenças musculares hereditárias causadas por mutações genéticas. A MCCN pode estar associada a mutações em diferentes genes, no DNM2, BIN1, MTM1, e RYR1, já a MCC está associada somente ao gene RYR1.
Esses tipos de doenças relacionadas ao RYR1 variam amplamente em termos dos seus diferentes sinais e sintomas, de quando eles inicialmente se apresentaram, além da sua respectiva gravidade. Embora sejam altamente variáveis, os sintomas presentes também dependem se a mutação do gene RYR1 é autossômica dominante ou autossômica recessiva.
Uma pergunta que sempre chega até mim é sobre as diferenças entre a Miopatia Centronuclear e a Miopatia Central Core. Assim, eu, enquanto portador da Miopatia Congênita Centronuclear (MCN), buscarei esclarecer pontualmente neste texto, me atendo ao tipo que me acomete, que é a pela mutação no gene RYR1.
Estas doenças apesar de terem sintomas parecidos e compartilharem de algumas características clínicas em comum, se confundem entre si, e apresentam com algumas diferenças distintas:
Miopatia Congênita Centronuclear (MCCN)
Miopatia Central Core (MCC)
Em resumo, a Miopatia Congênita Centronuclear e a Miopatia Central Core, ambas doenças relacionada ao RYR1, têm seus sintomas e sinais físicos que podem se parecer, podem se confundir, mas são diferentes, a contar da análise histológica das células musculares em uma biópsia, exame este que é crucial para diferenciar entre as duas condições e determinar o diagnóstico correto, conduta médica, tratamento, e até prognóstico de evolução.
Nota: todo o material escrito nesta página é oriundo de pesquisa científica, e conclusões próprias do autor deste website, que convive como portador, desde o nascimento, com a Miopatia Congênita Centronuclear causada pela mutação no gene RYR-1
As miopatias são doenças que afetam os músculos, e podem se apresentar desde o nascimento até a idade adulta. Quando a miopatia se manifesta no início da vida, é frequentemente referida como miopatia congênita e de origem genética.
O diagnóstico de miopatia em uma criança geralmente envolve uma combinação de exame físico, história clínica, testes laboratoriais, incluindo biópsia e exame genético, além de exames de imagem. O diagnóstico preciso depende da avaliação completa feita por um médico especialista em doenças neuromusculares pediátricas.
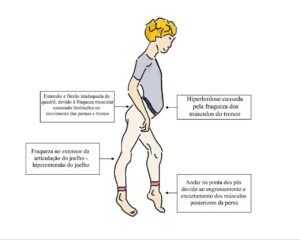
Existem alguns sinais físicos que são característicos em uma criança portadora de miopatia. Além do Movimento de Gowers, já descrito nesta website, o Sinal de Trendelenburg e a Marcha Miopática também são sinais físicos que podem ser cruciais no exame clínico quando do diagnóstico de uma miopatia. Esses sinais são incorporados como característica da doença, podendo ter um impacto significativo na qualidade de vida de quem a sofre, portanto, o acompanhamento e tratamento adequados são essenciais para ajudar os indivíduos a controlar os sintomas, limitações, evitar complicações secundárias, e manter uma boa qualidade de vida.
A Marcha Miopática é um termo médico usado para descrever um padrão de caminhada que é afetado pela fraqueza muscular causada por uma miopatia, que também é conhecida como Marcha do Pato. Essa condição provoca uma série de alterações na maneira de andar dos indivíduos afetados. Um dos sintomas mais característicos é também chamado de marcha bamboleante. Esta marcha é caracterizada pelo balanço do tronco e separação dos pés durante a caminhada. Como os músculos do tronco também são afetados, desencadeia-se uma postura anormal, apresentando como exemplo a hiperlordose lombar, que é uma curvatura excessiva na região lombar. Outra característica distintiva é andar na ponta dos pés, que provoca o espessamento e retração da musculatura posterior da perna, criando uma aparência de pseudo-hipertrofia. Nesta condição, os músculos tornam-se mais espessos e volumosos, mas na verdade é resultado da destruição da fibra muscular e da sua substituição por tecido fibroso ou fibras colágenas. Este padrão de marcha é uma característica comum em várias formas de miopatia e pode variar em gravidade dependendo do tipo e da progressão da doença.
O Sinal de Trendelenburg é uma característica bem comum em indivíduos afetados por uma miopatia, com fraqueza da musculatura abdutora do quadril, em especial o glúteo médio. O nome deste sinal é em homenagem ao cirurgião alemão Friedrich Trendelenburg. O sinal de Trendelenburg é positivo se, quando o quadril de um paciente que está de pé sustentado por somente uma perna, cai para o lado da perna levantada. A fraqueza é presente no lado da perna em contato com o chão. O corpo não é capaz de manter a perna estável, causando uma inclinação ou queda da pelve em comparação com o lado contralateral. Essencialmente, o Sinal de Trendelenburg é causado pela fraqueza dos músculos glúteo médio e mínimo.
O Sinal de Trendelenburg e a Marcha Miopática, apesar de poderem variar dependendo da miopatia, e da forma que ela se apresenta em cada indivíduo, ao longo do tempo, podem desencadear uma série de consequências no corpo (ufa ! …e eu que o diga…), podendo relacionar algumas delas:
Nota: todo o material escrito nesta página é oriundo de pesquisa científica, e conclusões próprias do autor deste website, que convive como portador, desde o nascimento, com a Miopatia Congênita Centronuclear causada pela mutação no gene RYR-1
ARMGO PHARMA PÚBLICA IMPORTANTES E POSITIVOS RESULTADOS DO ENSAIO DE FASE 1B DO RYCALl® ARM210 PARA O TRATAMENTO DE MIOPATIAS RELACIONADAS AO RECEPTOR DE RIANODINA 1
ARMGO Pharma, Inc. (ARMGO), uma empresa privada no setor biofarmacêutico que desenvolve uma nova classe de drogas de moléculas pequenas ou micro moléculas conhecidas como Rycals®, anunciou em 29 de janeiro de 2024 a publicação dos resultados de um estudo de Fase 1b de seu Rycal ARM210 (também conhecido como S48168), para o tratamento de miopatias relacionadas ao receptor 1 de Ryanodina (RYR1-RM), uma doença muscular órfã, também chamada de “doença rara”, por ser uma doença que afeta uma pequena percentagem da população.
2024 a publicação dos resultados de um estudo de Fase 1b de seu Rycal ARM210 (também conhecido como S48168), para o tratamento de miopatias relacionadas ao receptor 1 de Ryanodina (RYR1-RM), uma doença muscular órfã, também chamada de “doença rara”, por ser uma doença que afeta uma pequena percentagem da população.
Os dados foram publicados em um artigo intitulado 'Rycal S48168 (ARM210) para Miopatias Relacionadas ao RYR1: um ensaio de fase um, estudo em aberto, e de ensaio de escalonamento de dose', de autoria do Dr. Joshua Todd et al, no Journal eClinicalMedicine, parte da família de publicações Lancet. O artigo revisa os dados do estudo de Fase 1b do ARM210 e seu novo mecanismo de ação alostérico (MoA) visando a causa raiz da doença relacionada ao RYR-1 (RYR1-RM): mutação do Receptor 1 de Ryanodina (RYR1).
O gene RYR1 que codifica o Receptor 1 de Ryanodina RYR1, um canal intracelular de liberação de cálcio, vaza em doenças musculares. Vazamentos intracelulares de cálcio causados por canais RYR1 com mutação prejudicam a contração muscular, levando à fraqueza muscular e perda de função, e ativam vias tóxicas que danificam os músculos, causando os sintomas das doenças relacionadas ao RYR1.
O ensaio de Fase 1b, aberto, de escalonamento de dose confirmou a segurança, tolerabilidade e farmacocinética da dosagem de 120 e 200 mg de ARM210 diariamente durante 29 dias em homens e mulheres adultos afetados pelas doenças relacionadas ao RYR1 (RYR1-RM).
É importante ressaltar que o estudo também demonstrou eficácia preliminar no grupo de dose mais alta em dois sintomas característicos das doenças relacionadas ao RYR1 (RYR1-RM): 1) alívio significativo da fadiga avaliada pelo sistema PROMIS-fatigue (Patient-Reported-Outcome Measurement Information System) t-scores, e 2) melhora da força dos proximais avaliada pelo exame físico de abdução do ombro (Medical Research Council Grading). Estes resultados justificam o desenvolvimento futuro do ARM210 como um potencial tratamento e modificador da doença para as miopatias relacionadas ao RYR1 (RYR1-RM) em um ensaio de Fase 2 randomizado e controlado por placebo.
O ensaio de Fase 1b concluído foi conduzido em colaboração com o National Institute of Neurological Disorders and Stroke (NINDS) e National Institute of Health (NIH) sob um Acordo Cooperativo de Pesquisa e Desenvolvimento (CRADA - Cooperative Research and Development Agreement ), com o apoio da Fundação RYR-1, Pittsburgh, PA, EUA.

(Foto esquerda para direita: Dr. Tokunbor Lawal (autor da publicação), Dr. Mike Goldberg (co-fundador/Co-presidente de Pesquisas da Fundação RYR-1), e Dr. Payam Mohassel (Pesquisador Principal e Autor Senior)).
“Estamos muito satisfeitos com os resultados do ensaio com as doenças relacionadas ao RYR1 (RYR1-RM) conduzido em conjunto com o NIH, pois o estudo confirmou a segurança e tolerabilidade do ARM210, mas o mais importante, demonstrou pela primeira vez que o nosso Rycal®, ARM210, pode reverter os sintomas desta doença muscular crônica e devastadora em um curto período de tratamento. Isso é muito promissor”, disse Gene Marcantonio, M.D., Ph.D., CEO da ARMGO Pharma. “Esperamos, portanto, continuar rapidamente no desenvolvimento do ARM210 para levar este primeiro e potencial tratamento aos pacientes com as doenças relacionadas ao RYR1, com o apoio da Fundação RYR-1 e da comunidade de pacientes.”
Michael F. Goldberg, MD, MPH, co-presidente de pesquisa da Fundação RYR-1 acrescentou: “Estamos entusiasmados com a publicação deste importante estudo, pois representa um farol de esperança para muitos indivíduos e famílias de todo o mundo afetados pelas doenças relacionadas ao RYR1. Estamos ansiosos pelas próximas etapas de ensaios no desenvolvimento dessa importante droga.”
Mais informações sobre este estudo de Fase 1b podem ser encontradas online em: https://clinicaltrials.gov/study/NCT04141670. O ensaio foi apoiado pelos Programas de Pesquisa Intramural do NIH/NINDS, NIH/NINR, um NIH Clinical Center Bench to Bedside Award (2017-551673) e pelo parceiro de colaboração anterior da ARMGO, Les Laboratoires Servier. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente a opinião oficial dos Institutos Nacionais de Saúde.
BREVE REVISÃO SOBRE A FUNÇÃO DO RYR1 E DOENÇAS RELACIONADAS
Os RYRs são canais homotetraméricos de liberação de cálcio intracelular responsáveis pelo fluxo de Ca2+ dos retículos sarcoplasmáticos/endoplasmáticos (RS/RE) para o citoplasma da maioria dos tipos de células. RYR1 é a isoforma predominante no músculo esquelético de mamíferos, onde a liberação de Ca2+ via RYR1 é necessária para o acoplamento excitação-contração e função muscular normal. Já o RYR2 é a isoforma predominante no músculo cardíaco onde a liberação de Ca2+ via RYR2 é necessária para a função normal do músculo cardíaco. Mutações genéticas humanas nos genes RYR1 e RYR2 fazem com que o cálcio vaze dos canais RYR, levando à doença (Figura 1).
Os canais RYR normalmente alternam entre um estado de repouso (fechado) e excitado (aberto). Em certas doenças, em que existe a mutação genética, o RYR é modificado e torna-se incontinente ou seja, fica vazando. No caso do RYR1, este desempenha um papel crítico no músculo esquelético, e as mutações do RYR1 em humanos levam a uma miopatia progressiva, conhecida como doenças relacionadas ao RYR1 (RYR1-RM), privando o músculo da capacidade de responder eficazmente aos sinais de contração, levando à fraqueza muscular.
Sobre o Rycals® - A inibição do canal interromperia o vazamento, mas esta intervenção geralmente não seria benéfica, uma vez que bloquearia a função normal do RYR. O Rycals®, são moléculas que podem restaurar a função normal do canal sem bloquear o RYR, e abrem a possibilidade de intervenções terapêuticas.
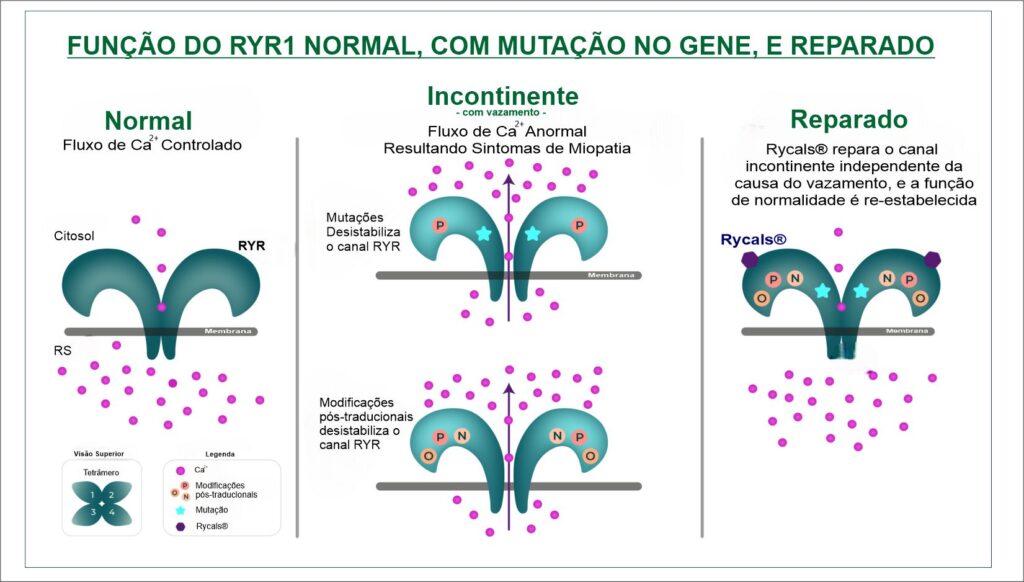
Figura 1: Modelo da função do RYR. O RYR controla o fluxo de cálcio (Ca2+) de dentro do retículo sarcoplasmático (RS) através da membrana até o citoplasma. (Quadro Esquerdo) O RYR normal regula o fluxo de cálcio alternando entre um estado fechado e aberto. (Quadro Meio) Na RYR1-RM, o RYR mutado apresenta vazamento, levando ao fluxo anormal de cálcio, resultando em sintomas da doença. Modificações pós-traducionais* (MPTs) do RYR agravam ainda mais o vazamento. Em outros distúrbios musculares, como DMD, insuficiência cardíaca ou sarcopenia, as modificações pós-traducionais (MPTs) do RYR podem causar vazamento no canal, levando a um fluxo anormal de cálcio, resultando em sintomas da doença. (Quadro Direito) Rycals® liga-se aos canais incontinentes (com vazamento) e repara o vazamento independentemente da causa do vazamento, restaurando a função normal do canal. O Rycals® não bloqueia o RYR.
*As modificações pós-traducionais (MPTs) são modificações químicas e estruturais de uma cadeia proteica após a sua tradução. Estas modificações podem determinar a atividade, a localização e interações com outras proteínas.
As doenças relacionadas ao RYR-1 são um grupo de doenças genéticas nas quais os músculos não funcionam corretamente. Em geral, as pessoas com essas doenças sofrem de fraqueza muscular ou baixo tônus muscular. Essas doenças podem causar diversos sintomas, que variam de fraqueza leve a fraqueza severa (em alguns casos, podendo ser necessário o uso de cadeira de rodas e de suporte respiratório).
A fraqueza muscular, fadiga muscular e astenia são sintomas comuns na maioria das formas das miopatias relacionadas ao RYR-1, e podem se sobrepor e / ou se confundirem entre si, o que pode tornar difícil distinguir entre eles apenas com base nos sintomas. Todos esses sintomas podem estar presentes em diferentes níveis de intensidade em pessoas com os diferentes tipos de miopatias, mas podem variar dependendo do tipo específico de miopatia, da sua gravidade, mas também de indivíduo para indivíduo. O diagnóstico preciso geralmente requer avaliação médica e, às vezes, e exames adicionais. Neste sentido, é muito importante destacar que a fraqueza muscular nas miopatias relacionadas ao RYR-1 pode ser acompanhada ou mesmo se confundir com outros sintomas, dentre eles a fadiga muscular, e astenia.
A FRAQUEZA MUSCULAR é um sintoma central e característico, resultando em fraqueza e redução da capacidade de mover os membros ou realizar atividades físicas. A fraqueza muscular na miopatia pode variar de leve a grave, dependendo do tipo e gravidade da doença. Ela pode afetar músculos específicos ou grupos musculares mais amplos, impactando as atividades diárias e a qualidade de vida do paciente. O tratamento da miopatia visa gerenciar os sintomas, retardar a progressão da doença e melhorar a função muscular, muitas vezes envolvendo uma combinação de medicamentos, terapia física e outras intervenções médicas específicas para cada caso.
A FADIGA MUSCULAR pode ser um sintoma significativo, pois pode ocorrer devido à disfunção dos músculos enfraquecidos, tornando-os menos eficientes na realização de atividades cotidianas. Isso pode levar a uma sensação de cansaço ou fadiga durante ou após o uso dos músculos afetados. O tratamento da miopatia muitas vezes envolve uma abordagem multidisciplinar, incluindo medicamentos, fisioterapia e gerenciamento dos sintomas para ajudar a minimizar a fadiga muscular e melhorar a qualidade de vida do paciente.
A ASTENIA, que é a sensação de fraqueza geral e falta de energia, pode ser um sintoma comum na miopatia. A fraqueza muscular decorrente da miopatia pode contribuir para essa sensação de astenia, levando a uma diminuição da capacidade de realizar atividades físicas e uma sensação geral de cansaço e exaustão. A astenia pode afetar significativamente a qualidade de vida dos pacientes com miopatia, limitando suas atividades diárias e impactando seu bem-estar emocional e mental. É importante que os pacientes com miopatia recebam um tratamento abrangente que leve em consideração não apenas a fraqueza muscular, mas também a astenia e outros sintomas associados, visando melhorar sua qualidade de vida geral.

Em recente postagem na página do SorRYR-1 no Instagram (@sorryr_1) em que me caracterizei com pequenas frases, fui muito questionado sobre um termo utilizado nos EUA, #ambulatorywheelchairuser, mas que aqui no Brasil ainda não é muito conhecido, “Cadeirante Ambulatório”.
Indivíduos afetados por uma doença neuromuscular tem uma grande probabilidade de ter sua mobilidade limitada no decorrer do tempo, e essa situação pode evoluir de maneira gradativa ou repentinamente.
A maneira com que nós, pessoas com deficiência física (PCD), encaramos nossa situação e a forma que vivemos diante de nossas adversidades evoluíram muito nos últimos anos, assim como pela maneira que sociedade nos veem.
Para que essa evolução acontecesse alguns conceitos tiveram que ser inseridos em nosso dia a dia, como por exemplo a inclusão social, acessibilidade, capacitismo, enfim, mas alguns termos também tiveram que ser lançados para nos caracterizar melhor diante da sociedade, como por exemplo, “Cadeirante Ambulatório”.
Cadeirante Ambulatório refere-se a pessoas com deficiência física ou doença crônica que usam cadeira de rodas, embora possam ter alguma capacidade de andar em circunstâncias limitadas e particulares. Há muitas razões pelas quais uma pessoa pode ser um cadeirante ambulatório, sendo a principal para melhorar sua liberdade e a qualidade de vida. Outro termo importante destacar neste momento é que existe o cadeirante ativo e cadeirante passivo, sendo que o primeiro consegue por si mesmo tocar a rodas a cadeira de rodas, e o passivo depende outra pessoa.
Recentemente foi publicado um artigo médico-científico tratando sobre a Pancreatite em Indivíduos com Doenças Relacionadas ao RYR1. O estudo teve participação de pesquisadores do Reino Unido, Holanda e Estados Unidos, além do nobre apoio da Fundação RYR1.
Mutações no gene do receptor de rianodina do músculo esquelético (RYR1) são uma causa comum de doenças neuromusculares hereditárias e têm sido associadas a um amplo espectro de fenotípico, variando de várias miopatias congênitas de início precoce com fraqueza muitas vezes substancial, até fenótipos induzidos em indivíduos “normalmente fortes” tais como a Rabdomiólise por Esforço (ERM) e suscetibilidade aos efeitos relacionados à anestesia, como a Hipertermia Maligna (HM). O gene RYR1 codifica o principal canal de liberação de cálcio do retículo sarcoplasmático (SR) com um papel crucial
no acoplamento excitação-contração (ECC), processo pelo qual um impulso neuronal elétrico é traduzido em contração muscular por meio da liberação de cálcio intracelular, estimulando o filamento contrátil. Mutações no gene RYR1 associadas à fraqueza muscular permanente normalmente prejudicam o processo excitação-contração (ECC) de forma eficaz, enquanto aquelas associadas com ERM e MH resultam em um receptor RYR1 hiperexcitável e muitas vezes aumenta desproporcionalmente a liberação de cálcio.
Os genes RYR1s foram implicados em processos essenciais de sinalização de cálcio em uma ampla gama de tecidos, mas as manifestações de doenças humanas associadas ao mau funcionamento do RYR1 em outros órgãos além do músculo esquelético até agora receberam pouca atenção. Descobriu-se que os genes RYR1s são amplamente expressos no pâncreas de mamíferos, através de seu papel nos processos de sinalização de cálcio intracelular, e têm sido criticamente implicados na função pancreática endócrina e exócrina.
No estudo foi relatado três casos com características principais de um distúrbio relacionado ao RYR1 e uma história adicional de pancreatite (aguda) inexplicável, sugerindo uma nova associação clínica de função perturbada do RYR1 não relacionada ao músculo estriado. Os três pacientes com diagnóstico de Miopatia Central Core (CCD), Síndrome de King-Denborough (KDS) e Suscetibilidade à Hipertermia Maligna (MHS), respectivamente, que além de seu (suposto) distúrbio relacionado ao RYR1 também desenvolveram sintomas e sinais de pancreatite aguda. Em dois pacientes, os episódios foram recorrentes, com grave envolvimento multissistêmico e sequelas. A sinalização de cálcio mediada por RYR1 desempenha um papel importante na função pancreática normal, mas também tem sido criticamente implicada na fisiopatologia da pancreatite aguda, particularmente nas formas induzidas por ácidos biliares e etanol. Os resultados de modelos animais relevantes indicam que os danos pancreáticos nestas condições podem ser melhorados através da administração do antagonista específico de RYR1, dantroleno, e de outros compostos que modificam o metabolismo pancreático, incluindo a sinalização de cálcio. Estas observações sugerem que os pacientes com variantes de ganho de função do RYR1 podem ter um risco aumentado de desenvolver pancreatite aguda, uma condição que deve, portanto, ser considerada na vigilância da saúde desses indivíduos.
Saiba mais detalhes sobre o tema
deste texto lendo a publicação
completa no artigo científico
clicando na imagem ao lado ⇒